宾夕法尼亚州立大学研究团队通过高分辨率计算机模拟,首次在原子水平上验证了一种新型蛋白质错误折叠机制的存在。这项研究为理解蛋白质错误折叠与阿尔茨海默病、帕金森病等疾病的关联提供了新线索,相关成果发表于《科学进展》期刊。
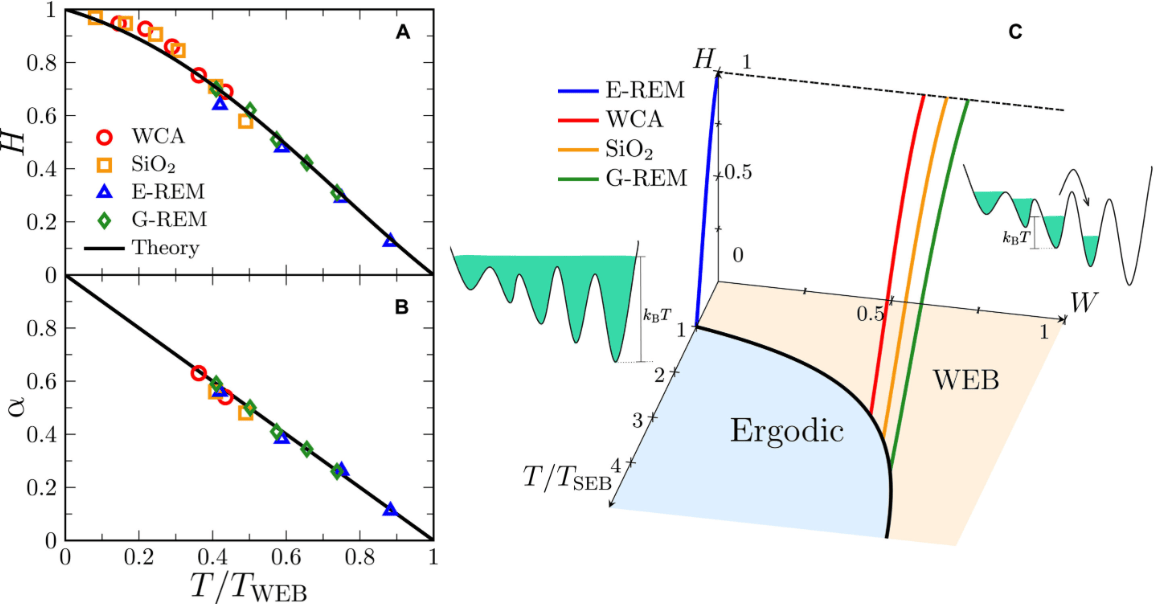
蛋白质错误折叠是指蛋白质在形成三维结构时偏离正常路径,导致功能丧失或毒性积累。此次研究发现的错误折叠类型涉及蛋白质内部“缠结状态”异常——即氨基酸链在不该缠绕时形成结状结构,或在需要稳定时未能缠绕。团队通过全原子模拟证实,这类错误折叠在较大蛋白质中更易持续存在,可能逃避细胞质量控制系统监测。
研究负责人、化学教授埃德·奥布莱恩表示:“蛋白质错误折叠是多种疾病的根源,也可能加速衰老。我们的模拟与实验数据高度吻合,为后续靶向治疗开发奠定了基础。”团队结合质谱实验数据,发现模拟中的结构变化与实验结果一致,进一步支持了该机制的可靠性。
论文第一作者Quyen Vu指出,小蛋白质中的错误折叠可快速修复,但正常尺寸蛋白质因结构复杂,错误折叠更易长期存在。这一发现有助于解释错误折叠蛋白质在细胞中的累积机制。奥布莱恩补充:“明确这类错误折叠的普遍性及稳定特性,将推动针对衰老和神经退行性疾病的新疗法研究。”
更多信息: Quyen Vu 等人,全原子模拟中观察到非天然纠缠蛋白错误折叠,并得到实验结构集合的支持,《科学进展》(2025 年)。期刊信息: Science Advances