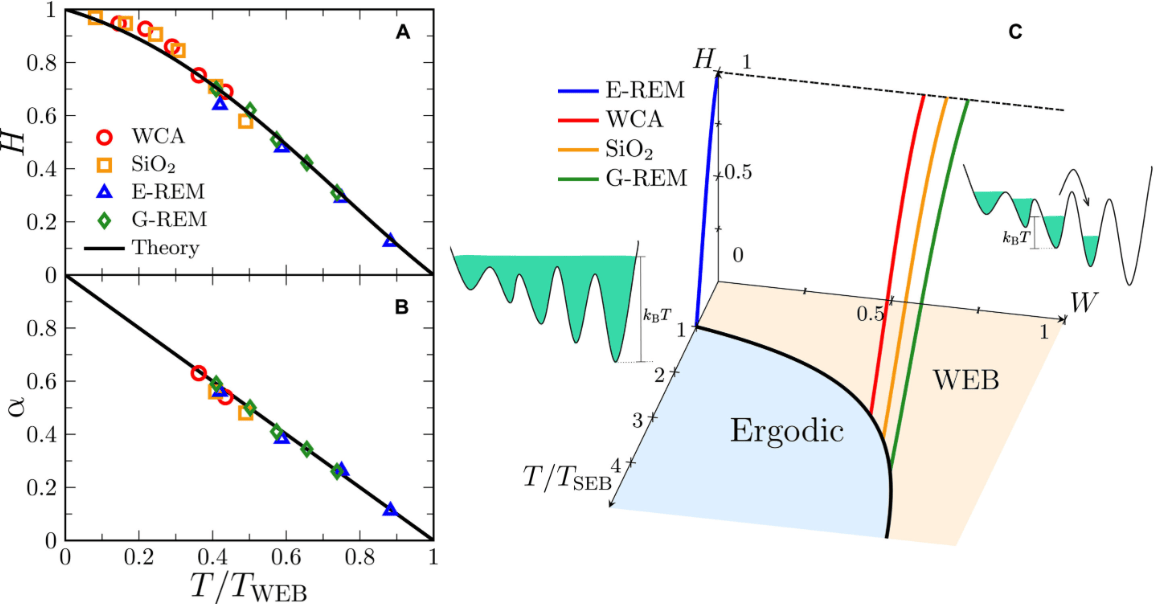
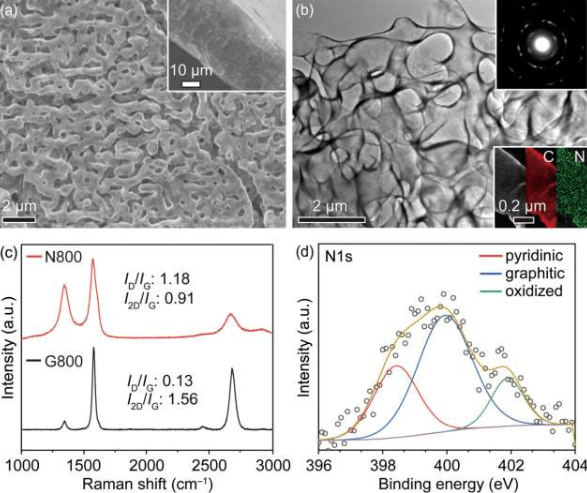
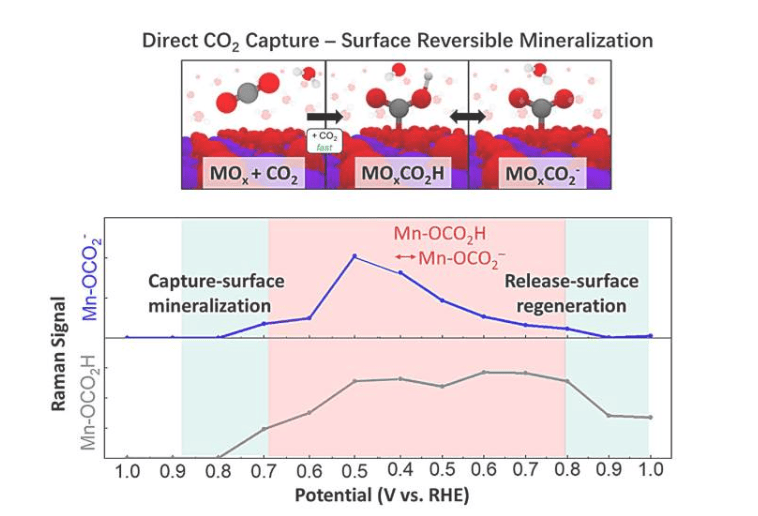
哥伦比亚工程学院研究团队开发出一种新型光控技术,通过调控活体胚胎中的蛋白质活性来实现对组织折叠过程的精确控制。这项突破为生物机器人和医学研究领域带来了新的可能性。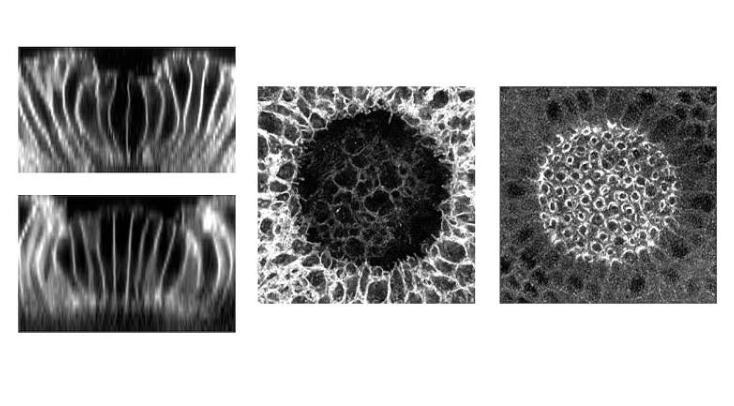
研究人员利用CRISPR-Cas9基因编辑系统,在果蝇天然基因中引入光敏模块,创建出名为"内源性OptoRhoGEF"的新型工具。该技术能够通过特定波长光照调控与细胞收缩相关的蛋白质活性,从而影响胚胎发育过程中的机械力模式。组织折叠研究是理解胚胎发育机制的重要途径。
研究团队负责人、机械工程副教授Karen Kasza表示:"能够精确控制组织片折叠的形状是迈向'组织折纸'的基础一步,它可用于研究发育胚胎外的3D组织生物学,或用于构建和控制由活体生物细胞制成的微型机器或机器人的运动。"
该研究首次实现了对细胞收缩力的可调式光控操作,而不仅仅是简单的开关式控制。实验发现,沟纹深度与细胞膜上收缩相关蛋白的数量直接相关,同时胚胎内部的硬质蛋白层也会显著影响组织沟纹的形成方式。这项组织折叠研究为理解胚胎发育过程提供了新视角。
生物医学工程博士生Andrew Countryman指出:"与果蝇胚胎类似,人类胚胎在发育过程中也广泛运用了沟壑形成过程。组织无法正常形成沟壑与常见且严重的先天性疾病(例如脊柱裂)有关。"该技术未来可能帮助科学家更好地分析组织和器官的发育和疾病。
新型光控技术为组织工程和再生医学提供了创新工具。研究人员计划进一步研究组织沟槽的其他形成方式,以及弯曲、拉伸和流动等组织行为,这些基本变形模式的组合构成了多样的器官和身体形态。组织折叠研究将继续推动发育生物学领域的进步。
更多信息: Andrew D. Countryman 等,《内源性 OptoRhoGEF 揭示上皮组织沟壑的生物物理原理》,《自然通讯》(2025)。期刊信息: 《自然通讯》