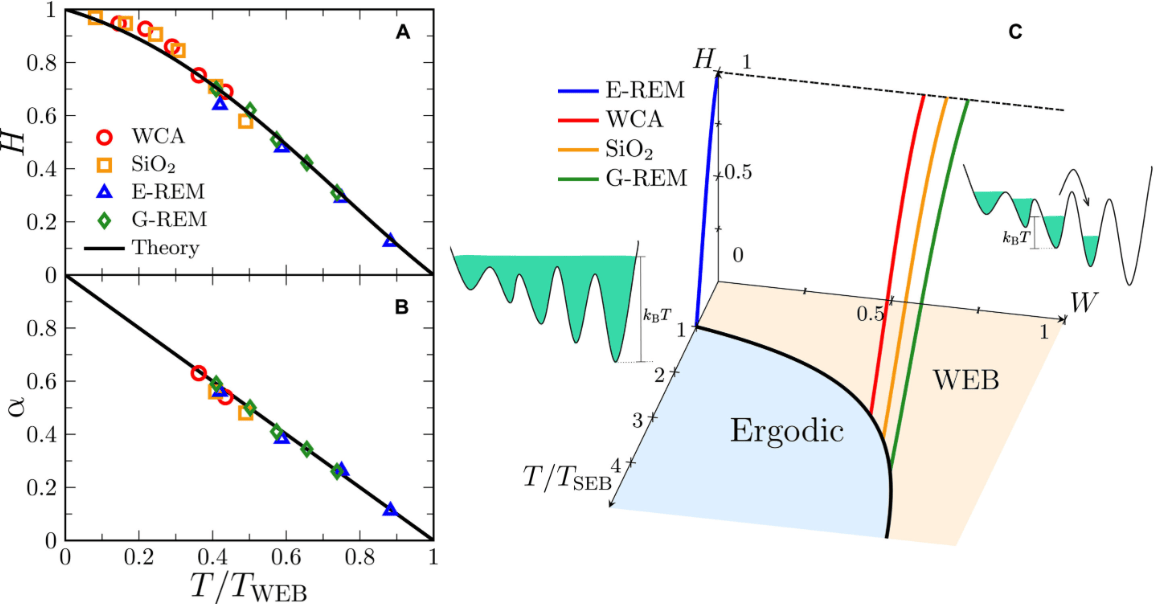
西北大学研究团队开发出一种新型脂质纳米颗粒球形核酸(LNP-SNAs),可显著提升CRISPR基因编辑系统的递送效率与安全性。该研究由化学教授Chad A. Mirkin领导,成果发表于《美国国家科学院院刊》。
基因编辑技术CRISPR面临的主要挑战是如何将编辑工具安全高效地递送至目标细胞。现有病毒载体易引发免疫反应,而脂质纳米颗粒(LNP)虽安全性较高但效率有限。西北大学团队设计的LNP-SNAs通过致密DNA外壳包裹CRISPR全套组件(包括Cas9酶、向导RNA及DNA修复模板),不仅保护编辑工具,还通过结构设计提升细胞靶向性与吸收效率。
实验显示,LNP-SNAs在人类皮肤细胞、白细胞、骨髓干细胞及肾细胞中的递送效率达到传统LNP系统的三倍,细胞毒性显著降低,基因编辑成功率提高60%以上。Mirkin表示:“通过使用SNA递送基因编辑所需的机制,我们的目标是最大限度地提高CRISPR的效率,并扩大我们能够递送CRISPR的细胞和组织类型的数量。”
该技术基于结构纳米医学原理,强调纳米材料结构而非成分对功能的影响。LNP-SNAs的DNA外壳可与细胞表面受体特异性结合,促进细胞主动内化过程,避免编辑工具被困于细胞内体。目前西北大学衍生公司Flashpoint Therapeutics已推进基于SNA的疗法进入二期临床试验,针对默克尔细胞癌等疾病。
Mirkin指出:“CRISPR可能会改变整个医学领域,但我们如何设计运载工具与基因工具本身同样重要。通过结合两种强大的生物技术——CRISPR和SNAs——我们创建了一种可以释放CRISPR全部治疗潜力的策略。”下一步团队将在多种疾病模型中验证该平台的体内应用潜力。
更多信息: 基于CRISPR脂质纳米颗粒球形核酸的通用基因组编辑策略,《美国国家科学院院刊》(2025)。期刊信息: 美国国家科学院院刊