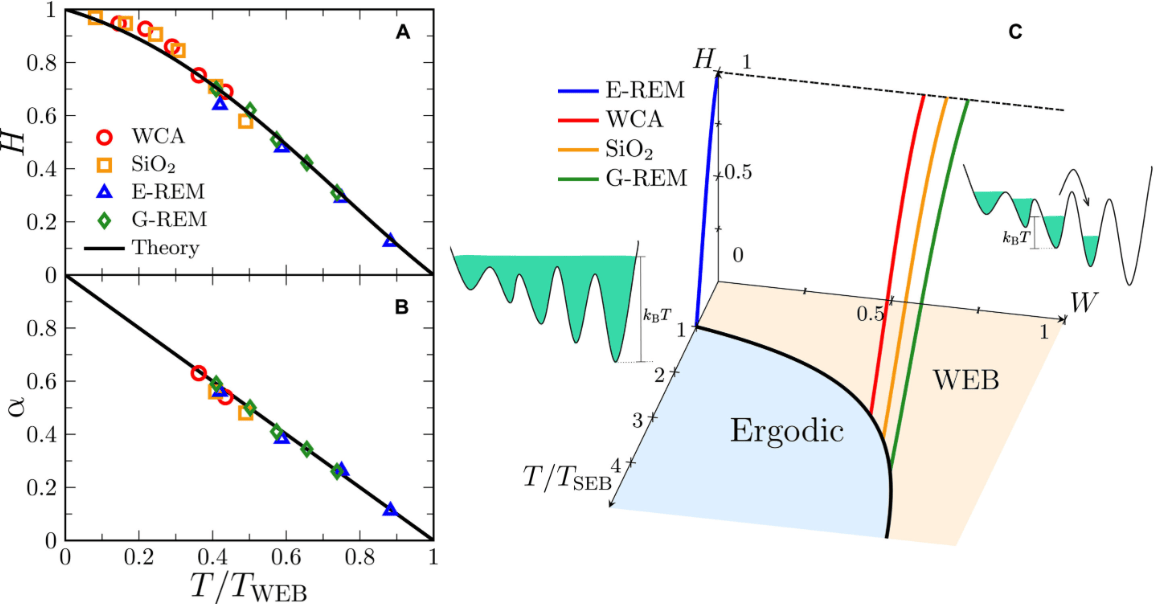
德国马克斯·普朗克光科学研究所的科研团队开发出一种新型芯片实验室系统,该系统利用智能水凝胶微结构对细胞所处的微观环境施加精确可控的压力。该方法已发表于学术期刊《芯片实验室》,未来或有助于研究组织机械性疾病并进行医学诊断。

细胞通常嵌在名为细胞外基质的三维网络结构中,其生物力学相互作用对许多生命过程至关重要。以往的实验工具难以集成到微型化系统中,且操控精度有限。由Katja Zieske博士领导的研究小组提出的新方法,能在芯片上实现对生物聚合物网络进行时空可控的机械扰动,从而观察相关生物过程的微观变化。
该系统的核心是利用智能水凝胶微结构作为微型执行器。这类材料由聚合物构成,可响应光或温度等刺激发生结构改变,从而收缩或膨胀。研究团队利用这一特性,对胶原蛋白等网络施加特定的生物力学力,并验证了该系统与活细胞的相容性。论文第一作者Vicente Salas-Quirós表示:“我们的方法能够以很高的空间和时间精度产生机械力,并记录它们对生物系统的影响。在胶原蛋白中,我们通过追踪荧光微球,即使在数百微米的距离上也能检测到这些力引发的变化。”
研究人员在流动腔室中制备并优化了热响应性水凝胶微结构,通过温度刺激使其膨胀,进而压缩不同的蛋白质网络。实验发现,Matrigel网络发生塑性形变,而胶原蛋白网络呈现弹性形变。该芯片实验室系统为研究细胞外基质重塑及机械力对细胞微环境的影响提供了一个多功能平台。
Katja Zieske博士展望了其应用前景:“我们的愿景是开发用于医学诊断的智能微结构,从而为可持续医疗保健系统做出贡献——例如,用于研究三维细胞模型系统,如癌症模型和血管形成模型。芯片实验室系统中的智能水凝胶微结构未来可以作为微型机器,在微米尺度上操控组织模型。我们看到了它在诊断应用方面的巨大潜力。”
更多信息: Vicente Salas-Quiroz 等人,《通过智能水凝胶微结构实现生物聚合物网络的刺激诱导机械压实》,芯片实验室(2025)。