Capricor Therapeutics公司推进DMD疗法BLA重审 计划第四季度公布III期数据
2025-09-26 17:05
收藏
生物技术公司 Capricor Therapeutics在与美国食品药品监督管理局(FDA)会面后,宣布将推进针对杜氏肌营养不良症(DMD)的细胞疗法候选药物deramiocel(CAP-1002)的研发进程。 Capricor Therapeutics公司计划完成正在进行的III期临床研究,并重新提交生物制品许可申请(BLA),以争取该疗法的最终获批。

根据Capricor Therapeutics公司的信息,其III期研究已纳入105名DMD患者,预计将于第四季度公布顶线数据。该数据将评估deramiocel在改善患者运动功能及延缓疾病进展方面的有效性。此前,FDA于7月发出完整回复函,要求Capricor补充更多临床证据以支持BLA审批。对此,Capricor表示将在数据公布后“尽快”回应FDA,推动候选药物重回审批轨道。
在9月25日的投资者电话会议中,Capricor首席执行官Linda Marban透露,与FDA官员的讨论聚焦于“优化数据呈现方式及明确后续临床试验设计”。她强调:“我们的目标是通过补充分析,清晰展示deramiocel对DMD患者的长期益处。”目前,deramiocel是少数进入III期阶段的DMD细胞疗法之一,其作用机制通过调节免疫反应及促进肌肉再生,试图缓解患者因基因突变导致的进行性肌肉萎缩。
尽管FDA未明确此次BLA重审的时间表,但Capricor Therapeutics公司重申对deramiocel潜力的信心。行业分析师指出,DMD领域长期缺乏有效治疗手段,若deramiocel成功获批,或为患者提供新的治疗选择。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

因美纳完成对SomaLogic收购,用于蛋白质组学市场布局
2026-02-01

万泰生物2025年斩获八项ESG殊荣,彰显可持续发展综合实力
2026-02-01
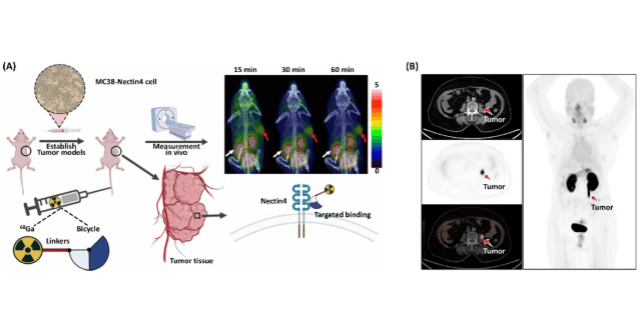
中国哈医大肿瘤医院联合团队研发新型PET/CT分子影像示踪剂
2026-02-01

圣彼得堡核物理研究所推进医用核素综合设施建设
2026-02-01

2026年制药行业并购趋势聚焦放射性药物与GLP-1供应链安全
2026-02-01

文莱实施人工智能心血管疾病预防计划
2026-02-01

Summit双特异性抗体ivonescimab获FDA审评日期
2026-02-01

Telix公司TLX591-Px前列腺癌成像试验在日本启动首例患者给药
2026-02-01

伍斯特郡医院实施Altera Digital Health电子处方系统提升医疗安全
2026-02-01
赛诺菲调整mRNA流感疫苗策略,CEO重申对疫苗业务信心
2026-02-01

