每年超 120 万人因抗生素耐药菌感染直接死亡,且这一数字还在攀升,抗生素耐药性已成为全球健康领域的 “沉默流行病”。传统广谱抗生素如同 “核弹”,在杀灭致病菌的同时会破坏肠道菌群平衡,反而为耐药菌定植创造条件。

而麦克马斯特大学团队发表在《自然・微生物学》的最新研究,不仅发现了一种能精准靶向致病菌的新型抗生素 “enterololin”,更借助 AI 技术将药物作用机制的研究时间从传统的两年压缩至六个月,为抗生素研发带来革命性突破。
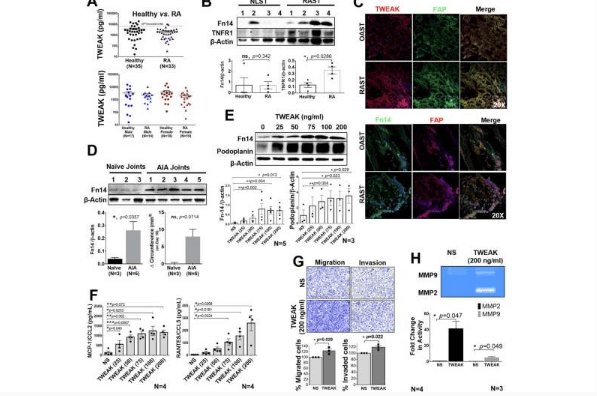
研究团队首先从 10,747 种生物活性小分子中筛选能抑制黏附侵袭性大肠杆菌(AIEC)的化合物——AIEC 是炎症性肠病(IBD)患者肠道中的常见致病菌,且临床分离菌株平均对四种以上抗生素耐药。通过严格的生长抑制标准(>95% 生长抑制)和结构筛选,团队最终锁定了名为 “enterololin” 的化合物。这种化合物展现出独特的窄谱抗菌活性:对肠杆菌科细菌(如大肠杆菌、肺炎克雷伯菌)有强效抑制作用,对铜绿假单胞菌、金黄色葡萄球菌等非肠杆菌科细菌则几乎无活性。当与亚抑制浓度的多粘菌素 B 类似物 SPR741 联用时,enterololin 的抗菌活性大幅提升,对临床分离的碳青霉烯耐药肠杆菌科(CRE)菌株的最小抑菌浓度(MIC)可低至 0.5 μg/ml 以下,轻松突破细菌的固有和获得性耐药机制。
更令人惊叹的是 AI 在破解药物作用机制中的表现。传统研究中,确定一种抗生素的作用靶点和机制需要耗费约 200 万美元、耗时两年,而团队使用升级后的 AI 模型 “DiffDock-L”,仅用 100 秒就预测出 enterololin 的作用靶点是细菌的 LolCDE 复合物。这种复合物是革兰氏阴性菌中负责脂蛋白从内膜转运到外膜的关键蛋白,对细菌生存至关重要。
为验证 AI 预测,研究人员通过实验室进化耐药突变株发现,耐药突变主要集中在 lolC 和 lolE 基因(编码 LolCDE 复合物的亚基),且耐药频率仅为 10⁻⁸至 10⁻⁷,与已知单靶点抗生素的耐药频率一致。进一步的转录组分析显示,enterololin 处理后,细菌中与脂蛋白转运相关的 Rcs 信号通路被激活,与 LolCDE 复合物功能异常的表型完全吻合,彻底证实了 AI 的预测。
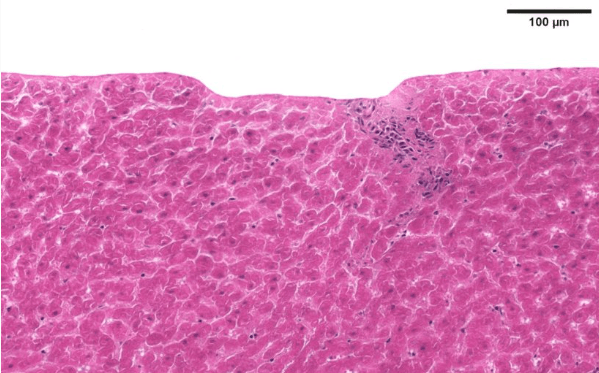
在动物实验中,enterololin 展现出优异的体内疗效和安全性:与 SPR741 联用后,能显著降低 AIEC 感染小鼠盲肠和结肠中的致病菌载量,部分小鼠甚至实现 AIEC “清零”;同时,其对人类胚胎肾细胞(HEK293)的半数抑制浓度(IC₅₀)超过 100 μg/ml,是对 AIEC MIC(3.125×10⁻² μg/ml)的 3200 倍以上,安全性极高。更重要的是,enterololin 对肠道菌群影响极小——16S rRNA 测序显示,其处理组小鼠的肠道菌群 α 多样性(Shannon 指数)和 β 多样性(Bray-Curtis 差异)与对照组无显著差异,仅选择性减少肠杆菌科细菌;而常用抗生素万古霉素则会导致菌群多样性显著下降,甚至促进肠杆菌科细菌富集,这对 IBD 患者尤为关键,因为肠道菌群失衡会加重病情。
这项研究的意义远超发现一种新药,更确立了 “AI 指导药物研发” 的新范式:传统药物机制研究依赖大量试错,而 DiffDock-L 通过扩大训练数据集(纳入 16,881 个 Binding MOAD 样本)、优化数据增强技术,能在未知结合口袋的情况下,精准预测药物与蛋白质的相互作用。团队还对比了其他 AI 模型(如 Boltz-2、Chai-1)和传统分子对接工具(GNINA),发现 DiffDock-L 的预测结果与实验验证的吻合度最高。目前,研究团队已成立初创公司 Stoked Bio,计划对 enterololin 进行结构优化,预计三年内推进至人体临床试验阶段。
尽管 AI 表现出色,研究人员仍强调其 “工具属性”:“AI 就像修复漏水水龙头的扳手,能帮我们更快解决问题,但无法替代实验验证。” 未来,团队希望进一步优化 AI 模型,探索其在药物溶解度、吸收性优化中的应用,甚至尝试设计无需 SPR741 辅助就能穿透细菌外膜的 enterololin 衍生物。在抗生素耐药性日益严峻的今天,这种 “AI + 窄谱抗生素” 的组合,不仅为 IBD 患者等易感人群带来希望,更重新定义了抗生素研发的效率边界,让人类在与 “超级细菌” 的博弈中终于掌握了一把精准的 “狙击枪”。