欧洲药品管理局(EMA)近日建议有条件批准新药Rezurock(belumosudil),用于治疗成人和12岁以上、体重不低于40公斤儿童的慢性移植物抗宿主病(GvHD)。该药物主要适用于其他治疗方案临床获益有限、不适用或已用尽的情况。
慢性移植物抗宿主病是一种长期且严重的疾病,可能危及生命,其特征是骨髓或干细胞移植后,供体细胞攻击宿主身体。该病可影响多个器官,引发皮肤纤维化、关节活动受限和肺损伤等并发症,严重影响患者身体功能和生活质量。在接受干细胞移植治疗血液癌症或免疫缺陷综合征等疾病的患者中,慢性GvHD的发病率在成人中为30%至70%,在儿童中为6%至33%。
目前,慢性移植物抗宿主病的标准治疗通常包括皮质类固醇,并常与其他免疫抑制药物联合使用。然而,这些疗法长期获益有限,且可能带来显著副作用,如感染风险增加、血细胞计数下降以及新增癌症风险。许多患者(50%至75%)需要尝试多种不同疗法,但有效的二线和三线治疗方案较为有限。长期来看,约三分之一的患者会经历原发病复发或死亡,三分之一能够成功停止治疗,另有三分之一需继续治疗。因此,慢性GvHD领域存在对更有效治疗方案的迫切需求。
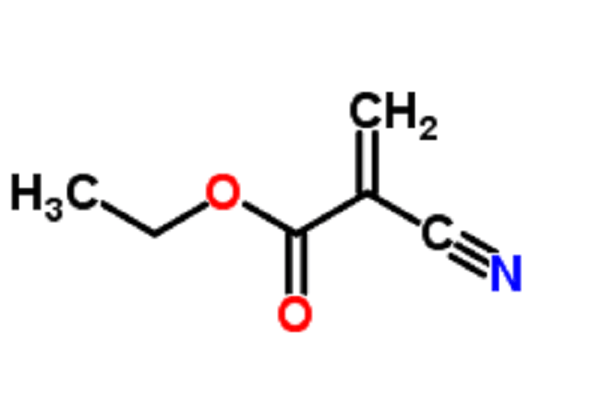
Rezurock的活性成分belumosudil是一种蛋白激酶抑制剂,通过阻断ROCK2蛋白发挥作用,该蛋白参与慢性GvHD的免疫反应过程。该药物以片剂形式提供,建议每日一次随餐服用。
EMA的这一建议基于一项开放标签研究的结果。该研究纳入了12岁及以上、慢性GvHD在皮质类固醇和至少两种先前全身疗法下未得到充分控制的患者。在为期6个月的观察中,每日服用Rezurock的患者中有73%对治疗产生反应,其中44%在6个月时仍保持反应。约5%的患者实现完全缓解,即所有受影响器官的症状全部消失;约68%的患者实现部分缓解,表现为至少一个器官改善且其他器官未恶化。
Rezurock报告的最常见副作用包括疲劳、腹泻、恶心、头痛、呕吐,以及肝酶(如天冬氨酸氨基转移酶、丙氨酸氨基转移酶和γ-谷氨酰转移酶)血液水平升高。
Rezurock获得的是有条件上市许可建议,这是欧盟的一项监管机制,旨在加速满足未满足医疗需求的药物上市。此类批准允许在数据尚未完全的情况下推荐药物上市,前提是药物对患者的即时益处大于数据不全带来的风险。为确认Rezurock的疗效,制药公司已承诺开展一项确认性随机对照研究。
人用药品委员会(CHMP)采纳的意见是Rezurock走向患者可及的重要步骤。该意见将提交欧盟委员会,以决定是否在欧盟范围内批准上市。一旦获批,各成员国将根据本国卫生系统情况,决定该药物的定价和报销政策。