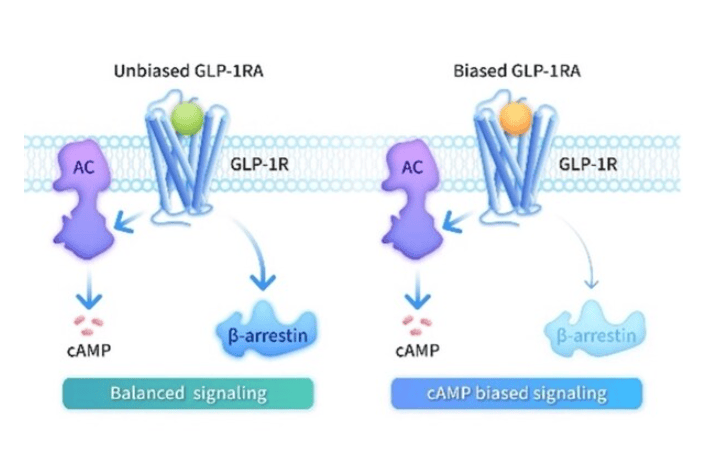
作为最致命的脑癌,胶质母细胞瘤(GBM)每年夺走全球数十万人的生命,而爱因斯坦医学院团队发表在《自然・神经科学》的最新研究发现,它的破坏力远超想象——不仅在大脑内疯狂增殖,还会悄悄 “啃食” 头骨、改造骨骼中的免疫环境,甚至让治疗骨质疏松的药物反过来促进肿瘤生长,这或许正是胶质母细胞瘤治疗屡屡失败的关键原因。

头骨并非毫无生气的 “保护壳”,近年来研究发现,头骨与大脑之间存在直径不足 100μm 的微小血管通道,免疫细胞可通过这些通道在两者间穿梭,而胶质母细胞瘤恰好利用了这一 “隐秘通道”。
研究团队通过两种小鼠胶质母细胞瘤模型(间充质亚型 SB28、混合亚型 GL261)发现,肿瘤会诱导颅骨出现广泛骨质侵蚀:高分辨率显微 CT 显示,小鼠颅骨密度和厚度显著降低,尤其是颅骨接缝附近的成骨边缘区域(这些区域在小鼠 1 周龄、人类 2 岁时就已融合,成年后本应稳定),即使是远离肿瘤的枕骨,侵蚀程度也最为严重。
更关键的是,这种骨质破坏是胶质母细胞瘤特有的——中风、脑外伤或颅内注射乳腺癌细胞(4T1)都不会引发类似变化,人类患者的 CT 数据也证实了这一点:26 名胶质母细胞瘤患者的颅骨厚度(尤其是人字缝、枕骨中部区域)显著低于 22 名年龄性别匹配的非肿瘤对照组,且这种变化与肿瘤大小、位置无关。
随着颅骨被侵蚀,头骨与大脑间通道的数量和直径也随之增加,为肿瘤 “操控” 头骨骨髓创造了条件。单细胞 RNA 测序揭示了免疫系统的 “叛变”:头骨骨髓中,本应抵抗感染的中性粒细胞数量几乎翻倍(从正常状态的 28.2% 增至 GL261 模型的 68.2%、SB28 模型的 52.5%),这些细胞会营造促肿瘤的炎症环境;而能产生抗体的 B 细胞几乎 “全军覆没”,多种 B 细胞亚型减少 60%-94%,严重削弱机体的抗肿瘤能力。更令人惊讶的是,头骨骨髓与腿骨骨髓对肿瘤的反应完全不同:肿瘤会激活头骨骨髓中促炎症、促增殖的基因(如胰岛素信号、FoxO 信号通路),却抑制腿骨骨髓中免疫细胞生成相关基因,这种 “远程操控” 证明胶质母细胞瘤是一种能影响全身的系统性疾病,而非局限于大脑的局部病变。
面对颅骨侵蚀,研究人员尝试用治疗骨质疏松的药物保护骨骼,却得到了反效果:FDA 批准的唑来膦酸(Zol)和 RANKL 抗体(αRANKL)虽能抑制破骨细胞活性、阻止颅骨侵蚀,但唑来膦酸会显著促进 SB28 亚型胶质母细胞瘤的进展,且两种药物都会抵消免疫检查点抑制剂(抗 PD-L1)的疗效——原本抗 PD-L1 能激活 T 细胞攻击肿瘤,让 SB28 模型小鼠存活时间延长,但与唑来膦酸或 αRANKL 联用时,T 细胞激活被抑制,炎症性中性粒细胞(高表达 PD-L1 和 Tim3)数量反而增加,导致免疫治疗完全失效。进一步分析发现,不同亚型胶质母细胞瘤对药物的反应存在差异:GL261 模型中小鼠存活未受明显影响,而 SB28 模型(间充质亚型)对药物更敏感,这也提示未来治疗需考虑肿瘤亚型的特异性。