FDA推新试点计划,激励美国药品生产
在关税政策调整及药品定价协议达成的背景下,美国食品药品监督管理局(FDA)本周启动了两项新举措,旨在提升药物制造在美国的吸引力。其中一项关键行动是,FDA于周五公布了一项新的试点优先计划,该计划聚焦于加快那些在美国进行产品测试和生产,且符合特定国内生产及生物等效性测试要求的仿制药制造商的审批流程。

该公司10月3日发布的新闻稿称,符合FDA国内生产和生物等效性测试标准的仿制药公司,特别是那些使用“API独家国内来源”的公司,将有资格获得优先审查。此试点优先计划响应了当前政府强调的制药行业在岸化策略。FDA强调,当前运往美国各地的药品中,超过半数在海外生产,而截至2025年,美国本土活性药物成分制造商仅占9%,远低于中国(22%)和印度(44%)的比例。此外,仿制药的试验及生物等效性测试也日益倾向于在海外进行,FDA警告称,这正逐步“削弱”美国的制药研发能力。
FDA药物评估和研究中心主任乔治·蒂德马什医学博士指出:“过度依赖外国药物制造和测试,不仅对国家安全和患者获取构成风险,还阻碍了对美国本土研究、制造和生产的投资。”他进一步说明,美国对海外生产的依赖“减缓了审查进程,增加了纳税人的负担,因为这些外国研究和测试地点需由FDA进行检查,而外国检查相较于国内检查,准备时间更长,成本也更高。”
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

Opus基因疗法启动MERTK相关视网膜色素变性临床试验
2026-01-31

FDA批准Spectrum Dynamics的Veritas.AI核成像降噪平台
2026-01-31
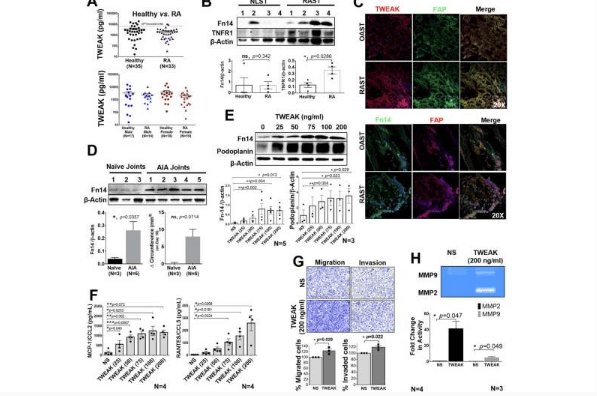
研究发现炎症新通路揭示类风湿关节炎治疗无效原因
2026-01-31

Ardena将瑞典API生产基地剥离给Nanologica
2026-01-31

Libris Innovations任命Ramani Varanasi担任首席执行官推动生物技术创新
2026-01-31

史赛克手持骨科机器人Mako RPS开展首批膝关节手术
2026-01-31

人工智能助力瑞典乳腺癌筛查提升检测效率
2026-01-31
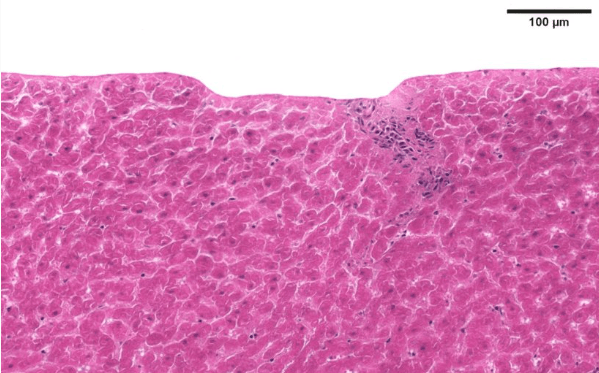
超快激光技术研究实现微米级精度肿瘤切除潜力
2026-01-31

Genyro获授权运用AI驱动DNA书写技术推动生物可编程性
2026-01-31

EMA审查罕见病药物Tavneos数据完整性
2026-01-31

