罗氏公司Elecsys pTau181测试获FDA批准
罗氏公司宣布,其Elecsys pTau181测试成为首个获FDA批准的基于血液的生物标志物检测,用于辅助评估阿尔茨海默病及其他认知下降原因,并适用于初级保健环境。该测试通过测量血浆中磷酸化tau 181(p-tau181)水平——阿尔茨海默病病理的关键标志物,旨在为55岁及以上出现认知症状的患者提供快速筛查,结合临床信息排除淀粉样病变相关疾病。
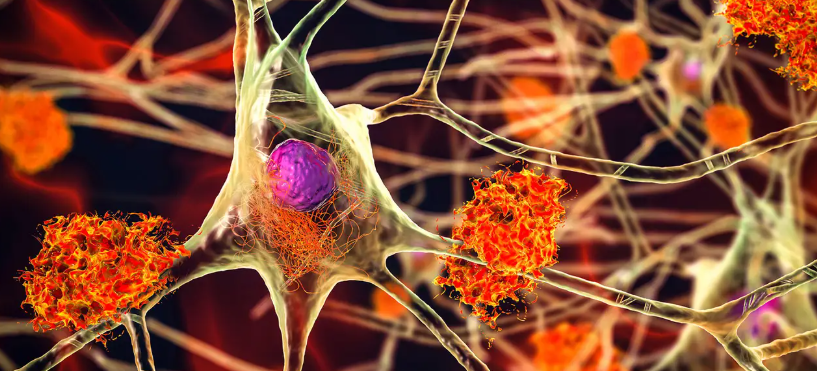
罗氏声明指出:“Elecsys pTau181检测可在初级保健中应用,显著拓宽患者获取微创检测的渠道,同时优化专科医生资源分配。”临床研究显示,在312名参与者中,该检测对阿尔茨海默病的阴性预测值达97.9%,可有效排除病理。此前,阿尔茨海默病协会发布的指南已支持血液检测的临床应用,要求敏感性至少90%、特异性75%,以辅助初步分类。今年5月,FDA批准了首个基于血液的阿尔茨海默病诊断测试Lumipulse G pTau 217/β-淀粉样蛋白1-42血浆比率,但仅限专科护理机构使用。
随着单克隆抗体药物(如lecanemab和donanemab)的推广,阿尔茨海默病的早期诊断需求日益迫切。罗氏Elecsys pTau181测试的获批,为初级保健医生提供了更便捷的筛查工具,有助于将高风险患者精准转诊至神经科医生,提升诊疗效率。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

大熊制药墨西哥签署Nabota出口协议,加速拉丁美洲市场布局
2026-02-01
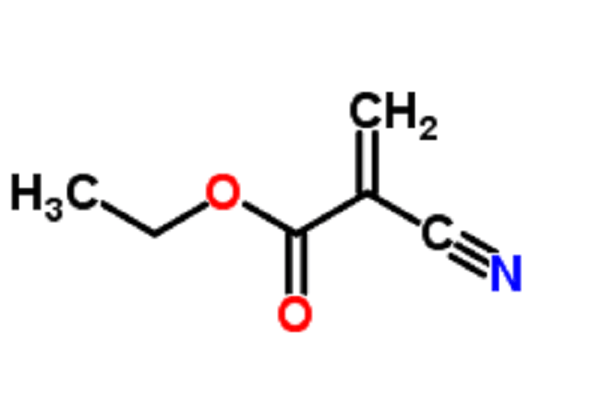
EUS引导氰基丙烯酸酯注射治疗胃静脉曲张出血效果显著
2026-02-01

巴达霍斯大学医院肺癌精准医疗与创新策略
2026-02-01
安眠药苏沃雷生可能降低阿尔茨海默病蛋白质水平
2026-02-01

NanoMosaic纳米针技术获得FDA先进制造技术认定,用于基因治疗质量控制
2026-02-01
Moderna与Recordati合作开发丙酸血症mRNA疗法
2026-02-01

西门子医疗爱尔兰研发中心投入运营,专注免疫分析仪器创新
2026-02-01
Tonix Pharmaceuticals发布TONMYA纤维肌痛治疗3期RESILIENT临床试验数据
2026-02-01
强生AKEEGA®双效片获CHMP积极意见,用于治疗携带BRCA突变的前列腺癌
2026-02-01
Baseline Therapuetics启动GLP-1药物治疗酒精使用障碍的三期临床试验
2026-02-01

