NEOK Bio获FDA批准启动双特异性ADC癌症治疗一期试验
2026-01-22 15:34
收藏
美国食品药品监督管理局(FDA)近日批准NEOK Bio公司提交的试验性新药(IND)申请,允许其开展针对实体肿瘤的NEOK001一期临床试验。这款创新疗法为全球首款同时靶向B7-H3和ROR1蛋白的双特异性抗体-药物偶联物(ADC),通过专用连接剂递送拓扑异构酶I抑制剂,旨在提升癌症治疗精准度并减少对健康组织的损伤。
临床前研究显示,NEOK001在实体肿瘤模型中展现出优于传统单靶点ADC的癌症治疗潜力,其双靶点设计可更精准识别癌细胞表面蛋白,同时通过优化连接剂技术提高药物稳定性。该疗法覆盖的靶点B7-H3和ROR1在乳腺癌、肺癌、卵巢癌及胃肠道肿瘤中高度表达,为多种难治性实体瘤提供潜在癌症治疗新选择。
此次获批使NEOK Bio得以启动首个人体癌症治疗临床试验,预计未来几个月内完成首例患者给药。研究将分阶段评估安全性、耐受性及初步疗效,首阶段癌症治疗相关数据计划于2027年公布。作为NEOK Bio管线中首个进入临床开发的产品,NEOK001的推进体现了公司聚焦下一代双特异性ADC癌症治疗领域的战略方向。
NEOK Bio由抗体工程领域专家ABL Bio支持成立,其研发团队在连接剂设计、载荷优化及多靶点协同机制方面拥有技术积累。此次IND获批为双特异性ADC癌症治疗领域注入新动力,有望解决传统疗法易产生耐药性及疗效局限等问题。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

中国徐州质子重离子医院项目竣工,加速推进医疗设备调试与团队培训
2026-03-09
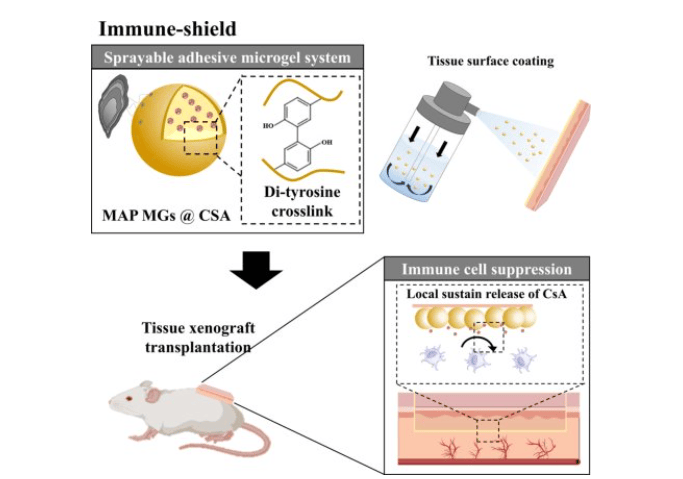
韩国浦项工科大学开发喷雾式免疫防护层技术,可有效预防器官移植排斥反应
2026-03-09
美国Diamond Orthotic Laboratory推进数字化牙科睡眠矫正器临床一致性
2026-03-09

赛默飞世尔科技在爱尔兰分销中心开业,增强生物制药供应链
2026-03-09

Salesforce在美国推出Agentforce for Health AI工具,用于医疗保健行业自动化
2026-03-09

美国医疗科技公司MedScout与Garner Health获融资,用于数字医疗领域
2026-03-09

e&与Aster Pharmacy在阿联酋推出'药房盒'计划,提升药房运营效率
2026-03-09

英国高地公司推出Elevate健康科技系列活动,连接供应商与NHS组织
2026-03-09

AJJ Medtech Holdings子公司获新加坡300万美元绿色医疗耗材供应协议
2026-03-09

医疗设备提升慢性病护理生活质量
2026-03-09
