礼来新药获FDA突破性疗法认定
2026-01-23 11:35
收藏
近日,礼来公司宣布,美国食品药品监督管理局(FDA)已授予其研发的sofetabart mipitecan(LY4170156)突破性疗法资格,用于治疗特定成人铂耐药上皮性卵巢癌、输卵管癌或原发性腹膜癌患者。这些患者需既往接受过贝伐珠单抗及索米妥昔单抗治疗,且符合用药条件。

礼来研发的新药此次认定基于LY4170156的Ia/b期研究积极数据。结果显示,该药物在各剂量水平下均展现疗效,且疗效不受患者FRα表达水平限制。即便是对索米妥昔单抗治疗产生耐药性的患者,LY4170156仍能带来临床获益。此外,药物耐受性良好,间质性肺病、周围神经病变等不良反应发生率较低,且未观察到显著眼部毒性。
目前,LY4170156已进入III期FRAmework-01临床试验阶段(NCT07213804),该研究于2025年10月9日启动,包含两部分:A部分评估LY4170156对比化疗或索米妥昔单抗治疗铂耐药卵巢癌的有效性与安全性;B部分评估其联合贝伐珠单抗对比铂类化疗联合贝伐珠单抗治疗铂敏感卵巢癌的效果。研究以无进展生存期(PFS)为主要终点。
LY4170156是Mablink Bioscience(已被礼来收购)开发的FRα ADC药物,采用自主研发连接子技术,搭载依沙替康作为有效载荷,药物抗体比(DAR)值为8。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

中国徐州质子重离子医院项目竣工,加速推进医疗设备调试与团队培训
2026-03-09
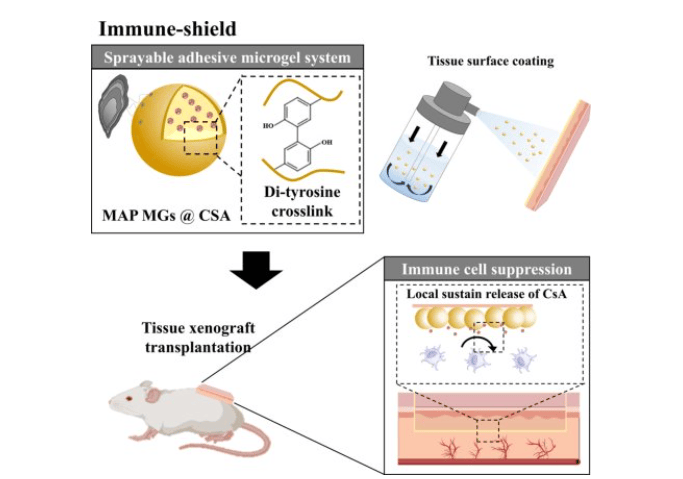
韩国浦项工科大学开发喷雾式免疫防护层技术,可有效预防器官移植排斥反应
2026-03-09
美国Diamond Orthotic Laboratory推进数字化牙科睡眠矫正器临床一致性
2026-03-09

赛默飞世尔科技在爱尔兰分销中心开业,增强生物制药供应链
2026-03-09

Salesforce在美国推出Agentforce for Health AI工具,用于医疗保健行业自动化
2026-03-09

美国医疗科技公司MedScout与Garner Health获融资,用于数字医疗领域
2026-03-09

e&与Aster Pharmacy在阿联酋推出'药房盒'计划,提升药房运营效率
2026-03-09

英国高地公司推出Elevate健康科技系列活动,连接供应商与NHS组织
2026-03-09

AJJ Medtech Holdings子公司获新加坡300万美元绿色医疗耗材供应协议
2026-03-09

医疗设备提升慢性病护理生活质量
2026-03-09
