质子是生物能量学的基础。质子在生物系统中移动的能力对生命至关重要。《美国科学院院刊》上的一项新研究首次表明,在蛋白质等手性生物环境中测量时,质子的转移直接受到电子自旋的影响。换句话说,生物系统中的质子运动并非纯粹的化学过程;它也是一个涉及电子自旋和分子手性的量子过程。
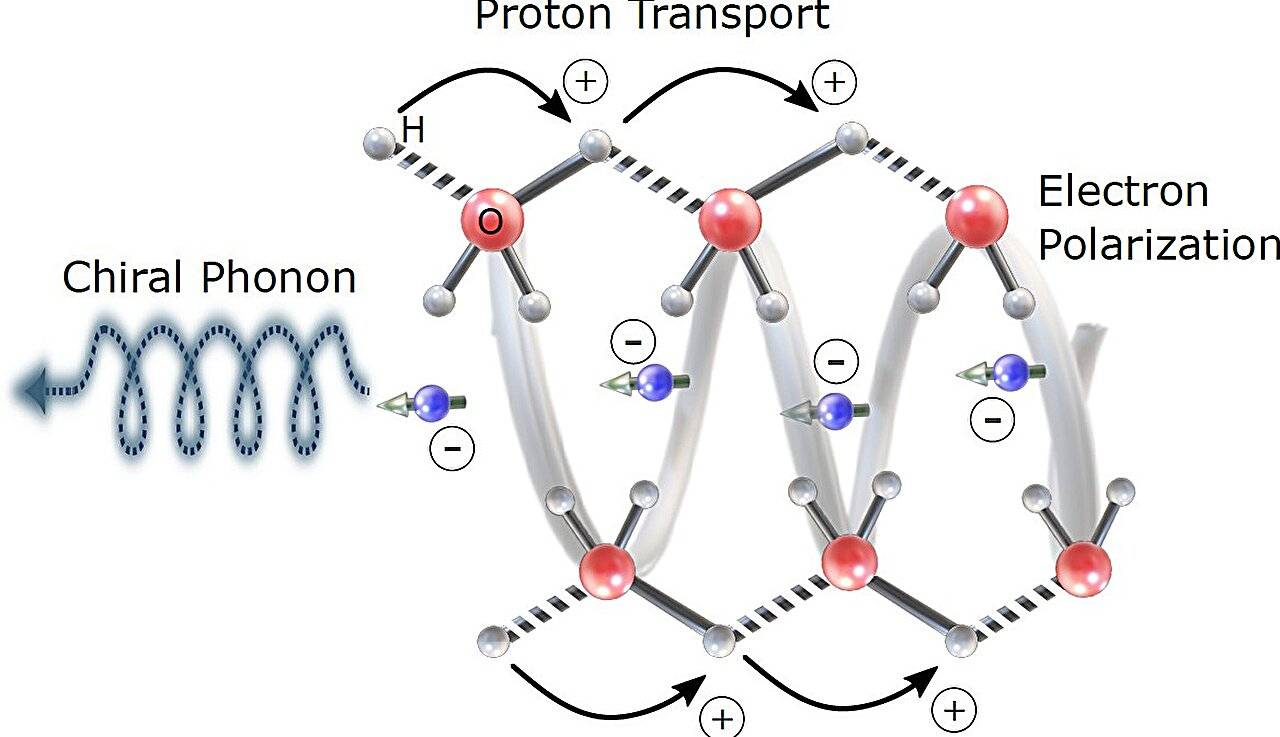
量子过程直接影响支持质子转移的生物环境中的微小运动。这一发现表明,生命中的能量和信息传递比以往认为的更具可控性、选择性和潜在的可调谐性,从而将量子物理学与生物化学连接起来,为从最深层次理解生命以及设计能够模拟或控制生物过程的技术打开了新的大门。
这项研究由耶路撒冷希伯来大学的研究小组领导,与魏茨曼科学研究所的 Ron Naaman 教授和本·古里安大学的 Nurit Ashkenasy 教授合作,揭示了生物系统中电子和质子运动之间的惊人联系。
该团队由应用物理系和纳米中心的 Naama Goren 和 Yossi Paltiel 教授以及希伯来大学生命科学研究所的 Nir Keren 教授和 Oded Livnah 领导,发现在某些生物晶体中,如溶菌酶(一种存在于许多生物体中的酶),被称为电子和质子的微小粒子不仅仅是独立移动,它们是紧密相连的。
质子传输对许多生命过程至关重要,例如细胞如何产生能量。迄今为止,人们普遍认为质子主要通过在水分子和氨基酸之间跳跃来移动。但这项新研究表明,这种运动也与电子自旋有关——自旋是一种描述电子如何像微型磁铁一样运动的量子特性。
研究人员证明,当他们将具有特定自旋的电子注入溶菌酶晶体时,它显著改变了质子穿过材料的难易程度。
当注入自旋相反的电子时,质子运动明显受到阻碍。这种效应与手性声子的激发有关——手性声子是晶格中的振动,介导电子自旋和质子迁移率之间的耦合。
这一发现与一种被称为手性诱导自旋选择性 (CISS) 效应的现象有关,该效应解释了手性 (或“手性”) 分子(具有特定扭曲或形状的分子)如何与电子自旋发生不同的相互作用。
“我们的研究结果表明,质子在生物系统中的移动方式不仅与化学有关,还与量子物理有关,”戈伦说。“这为理解信息和能量在生物体内的传递方式打开了新的大门。”
Paltiel 教授补充道:“电子自旋和质子运动之间的这种联系可能会带来模拟生物过程的新技术,甚至带来控制细胞内信息传递的新方法。”
通过将量子物理学和生物化学结合起来,希伯来大学团队的研究为生命的内部运作提供了新的见解,并可能为医学、能源和纳米技术的创新铺平道路。
更多信息: Paltiel、Yossi 等人,《手性生物晶体中电子自旋与质子转移的耦合》,《美国国家科学院院刊》(2025)。期刊信息: 美国国家科学院院刊