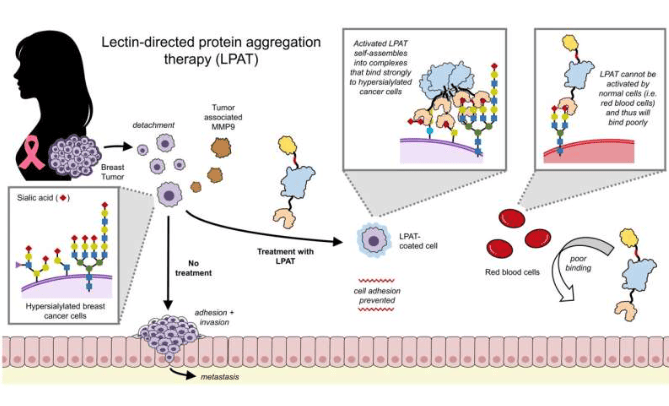
伦敦理工学院Sonja Lorenz教授团队在泛素连接酶研究领域取得新发现。该研究揭示了类药物化合物与HUWE1泛素连接酶相互作用的独特机制,相关成果发表于《自然通讯》期刊。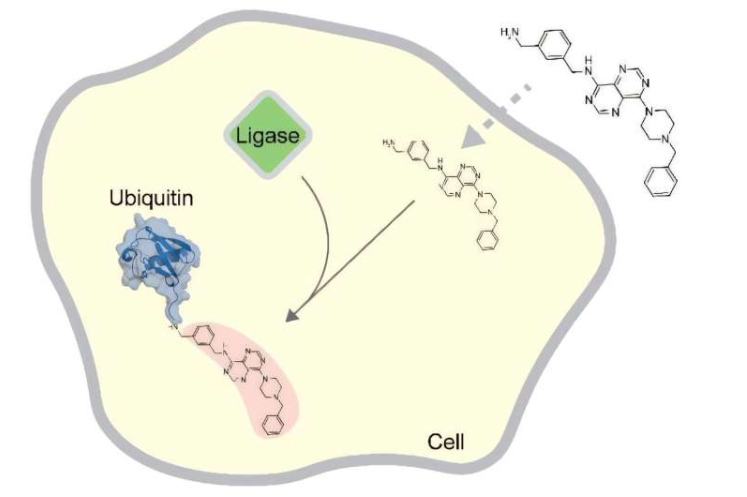
研究人员采用跨学科方法,结合蛋白质生物化学、细胞生物学和点击化学技术开展实验。研究发现,作为HUWE1抑制剂销售的类药物化合物并不会抑制这种酶,而是被HUWE1识别为目标分子并进行泛素标记。主要作者Pavel Pohl表示:"当类药物化合物在试管中过量供应时,它们会消耗泛素。这种竞争关系此前被误解为抑制效应。"
研究团队首次证实合成化合物在活细胞中也能发生泛素化过程。然而,细胞环境中的情况更为复杂:除了HUWE1外,其他泛素化酶也参与了对类药分子的泛素标记。这一发现具有重要意义,因为此前仅在生物分子上观察到泛素信号,从未在合成化合物上发现过。
该研究为开发调控细胞泛素系统的新方法提供了思路。Sonja Lorenz指出:"新的底物谱对于治疗和生物技术应用具有重要意义。我们的发现为开发调节细胞过程的新策略奠定了基础。"
更多信息: Barbara Orth 等人,泛素连接酶 HUWE1 对类药物小分子的选择性泛素化,《自然通讯》(2025)。期刊信息: 《自然通讯》