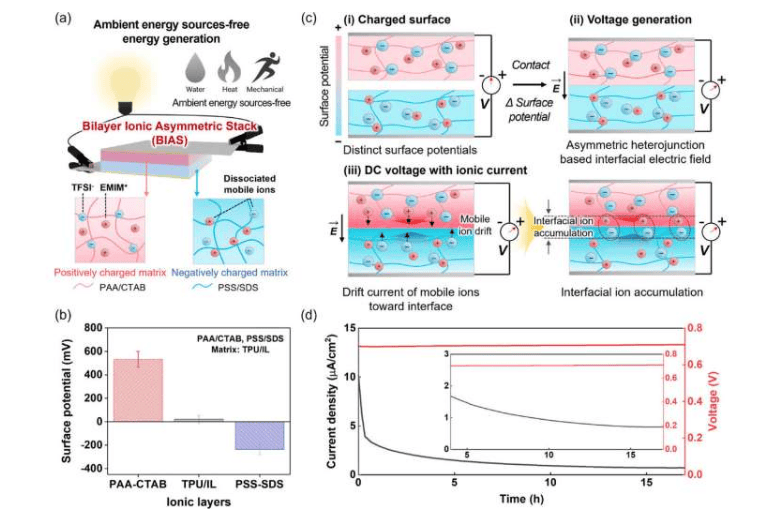
德国马克斯普朗克生物化学研究所、哥廷根大学医学中心与加拿大多伦多大学研究人员首次利用冷冻电镜断层扫描技术解析了蛋白酶体储存颗粒的详细分子结构。这项成果发表在《细胞》杂志上。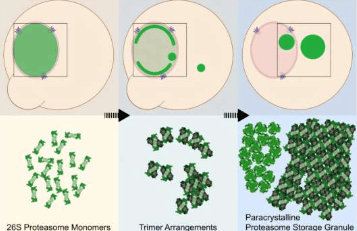
蛋白酶体是存在于所有真核生物中的大型蛋白质复合物,负责清除特定及受损蛋白质。当细胞面临葡萄糖短缺或线粒体ATP合成受阻等能量压力时,蛋白酶体会重新组织形成储存颗粒以暂停能量消耗。
马克斯普朗克生物化学研究所所长布伦达舒尔曼教授表示:“得益于与冷冻电镜断层扫描专家沃尔夫冈鲍迈斯特教授的合作,我们现在能够从分子水平上了解蛋白酶体储存颗粒的功能。”
研究团队在能量短缺的酵母细胞中发现,蛋白酶体并非形成无定形簇或动态液滴,而是排列成类似晶体的精确重复结构。该研究第一作者之一、马克斯普朗克生物化学研究所与哥廷根大学医学中心的唐晓萌博士解释道:“我们首次发现单个蛋白酶体可以排列成类似晶体的精确重复结构。这非常具有启发意义,因为我们观察到的现象与之前认为蛋白酶体储存颗粒会组装成无定形簇或动态液滴的预期相悖。”
研究显示,蛋白酶体首先结合形成三聚体,随后堆叠成纤维并进一步聚集成束状结构。共同第一作者、来自该研究所的卢曲博士指出:“我们只能在细胞内证明这种蛋白酶体排列,而无法在试管中证明。当我们试图分离蛋白酶体结构时,这些结构会解体——这就是为什么冷冻电镜断层扫描至关重要。”
在能量短缺期间,这些颗粒保持完全组装但处于非活性状态。一旦能量供应恢复,储存的蛋白酶体能够迅速恢复功能。舒尔曼教授解释:“这项发现为我们提供了一种新的视角,即通过分子机器结构良好的区域之间的接触来形成无膜细胞器。”鲍迈斯特教授总结道:“研究细胞内部的结构——例如天然环境中的蛋白酶体——从根本上改变了我们对细胞组织和功能的理解。”
出版详情:作者:Xiaomeng Tang等,标题:代谢调控的蛋白酶体超分子原位组织,发表于:《Cell》(2026),期刊信息: Cell