FDA启动PreCheck试点项目申请
2026-01-23 15:03
收藏
美国食品药品监督管理局(FDA)宣布,将于2月1日正式开启PreCheck试点项目的申请通道,持续至3月1日,旨在通过这一举措加强国内药品供应链的稳定性。PreCheck项目于2025年8月提出,是FDA对相关行政命令的回应,旨在为关键药物的国内生产提供监管支持。

FDA规划该项目通过两步策略激励企业于美国境内新建制造设施,一方面提供工厂建设早期的反馈,另一方面简化药品审批提交的部分流程。周三,FDA公布了项目实施路线图,明确4月1日将选出最终候选人,并给予一个月时间补充信息,首批参与者选拔截止日期为6月30日。选拔将依据参与者与国家优先事项的整体一致性,包括生产产品、设施开发阶段、生产美国市场药品的时间表以及设施开发创新等因素。
目前,PreCheck项目的许多细节尚未明晰。FDA表示,正根据去年公开会议和书面意见反馈修订项目,但仅在高层公开谈论了反馈及其纳入试点的请求。FDA官员计划在2月1日申请网站上线时提供更多信息。业界对PreCheck项目整体评价积极,认为它有望降低与设施相关的药物拒绝风险,但也呼吁明确具体细节。制造商、服务提供商和行业团体希望FDA将项目扩展至现有工厂,将检查与药品审批文件分开,并更新批准后的变更规则。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

中国徐州质子重离子医院项目竣工,加速推进医疗设备调试与团队培训
2026-03-09
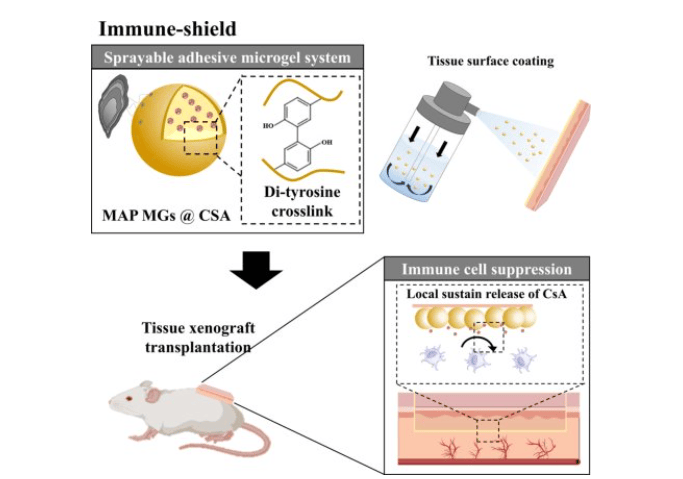
韩国浦项工科大学开发喷雾式免疫防护层技术,可有效预防器官移植排斥反应
2026-03-09
美国Diamond Orthotic Laboratory推进数字化牙科睡眠矫正器临床一致性
2026-03-09

赛默飞世尔科技在爱尔兰分销中心开业,增强生物制药供应链
2026-03-09

Salesforce在美国推出Agentforce for Health AI工具,用于医疗保健行业自动化
2026-03-09

美国医疗科技公司MedScout与Garner Health获融资,用于数字医疗领域
2026-03-09

e&与Aster Pharmacy在阿联酋推出'药房盒'计划,提升药房运营效率
2026-03-09

英国高地公司推出Elevate健康科技系列活动,连接供应商与NHS组织
2026-03-09

AJJ Medtech Holdings子公司获新加坡300万美元绿色医疗耗材供应协议
2026-03-09

医疗设备提升慢性病护理生活质量
2026-03-09
