美国食品药品监督管理局(FDA)已确定将在11月14日前对Summit Therapeutics公司研发的双特异性抗体药物ivonescimab的上市申请作出最终裁决。这一监管决定可能为癌症治疗领域带来新的选择。

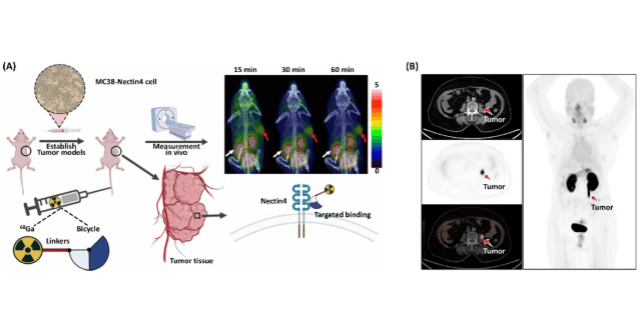
FDA于近期接受了该公司的新药申请,正式启动为期超过九个月的审评流程。该药物由Summit从康方生物获得授权,是一种同时靶向PD-1和VEGF的双重抑制剂,拟用于联合化疗治疗携带EGFR突变的局部晚期或转移性非鳞状非小细胞肺癌患者。
若获得批准,双特异性抗体药物ivonescimab有望成为当前由默克公司Keytruda主导的PD-1抑制剂市场的重要竞争者。2024年9月公布的一项III期研究数据显示,该药物在非小细胞肺癌治疗中将患者的无进展生存期提升了接近50%。
然而,该药物的研发过程并非一帆风顺。2025年5月完成的III期HARMONi研究虽然证实了其在无进展生存期方面相较于安慰剂的显著优势,但未能达到总生存期的预设终点。研究显示,ivonescimab联合化疗方案使全因死亡风险降低21%,但这一结果未达到统计学显著性要求。
FDA此前曾向Summit明确表示,具有统计学显著意义的总生存期获益是支持药物获批的必要条件。尽管如此,该公司在2025年10月的投资者沟通会上仍表达了提交上市申请的决心。Summit首席监管、质量和药物警戒官Urte Gayko在会议中表示:“我们确实认为,我们结合疗效和安全性数据的整体是一个强有力的方案。”
公司对双特异性抗体药物ivonescimab的信心部分来源于2025年9月披露的亚组分析结果。数据显示,亚洲患者群体在接受该药物治疗后死亡风险降低24%,而北美和欧洲患者的生存获益为16%。
Truist Securities分析师在近期报告中指出:“关键在于,Ivonescimab在EGFR突变肺癌中的监管路径尚不确定,且依赖于FDA的审评考量。”随着11月审评截止日期的临近,行业将密切关注FDA对这一双特异性抗体的最终决定。