莱斯大学研究团队近日在构建功能性蛋白质纳米结构方面取得技术进展。该团队开发出一种两阶段基因调控系统,旨在更高效、可持续地在工程细胞中生产复杂纳米结构,相关研究成果已发表于《自然通讯》期刊。
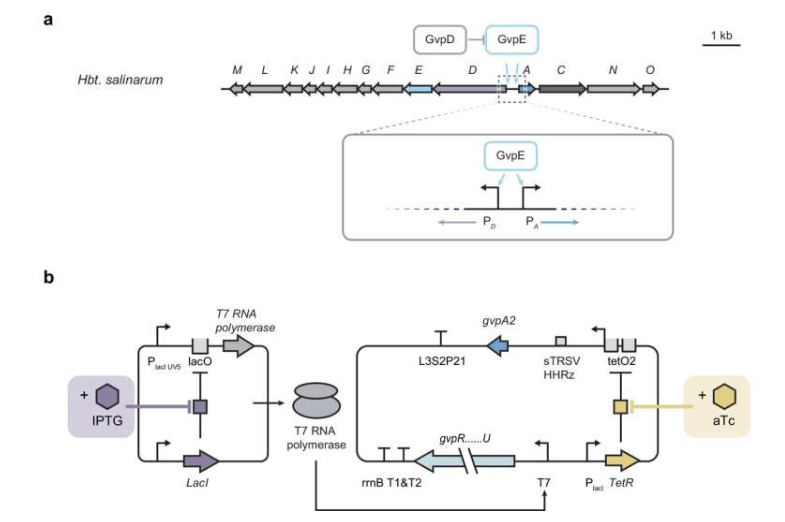
此项工作由莱斯大学生物工程系助理教授乔治·卢领导。研究聚焦于气体囊泡,这是一种由微生物产生的空心圆柱形蛋白质纳米结构。这类结构因其独特的声学特性,被视为在生物医学传感、成像及治疗领域具有应用潜力的纳米工具。
然而,在实验室利用工程细菌(如大肠杆菌)生产这类由多种蛋白质构成的复杂结构面临挑战。同时表达多个相关基因会给宿主细胞带来巨大压力,影响其存活并限制目标结构的产量。卢教授指出:“过去几年的研究表明,气体囊泡反射声音的能力使其成为生物医学研究和临床应用中独特而多功能的声学报告系统。但我们开发了一种新的基因调控系统,该系统能够确保宿主细胞保持健康,同时还能产生功能性纳米结构。”
为解决这一问题,研究团队设计了一种两步法策略。该策略的核心在于精确控制不同蛋白质组分的表达时序与水平。具体而言,他们先诱导表达负责结构组装的“因子”蛋白,待其准备就绪后,再启动构成囊泡主体“外壳”蛋白的表达。
该研究的主要参与者、卢教授的实验室前研究生李宗儒解释了其原理:“在诱导外壳蛋白之前,让组装因子提前两到三个小时开始运作,可以确保在引入主体结构蛋白之前,构建结构所需的细胞机制已经到位。” 这种方法改变了蛋白质表达从同步到顺序的模式,有效降低了细胞应激。
卢教授总结道:“通过将生产方式从同步生产转变为顺序生产,这种基因调控系统将混乱的组装过程转变为有序的生产流程。其结果是宿主生物体更健康,气泡产量更高。这种方法为临床和研究应用提供了一种稳健可靠的气泡生产方法,也可以用于生产其他多组分蛋白复合物。” 这项关于基因调控与蛋白质纳米结构合成的技术,为未来设计和生产更复杂的生物纳米材料提供了新思路。
出版详情:作者:李宗儒等,标题:《时间基因调控实现气体囊泡的受控表达并维持细菌活力》,发表于:《自然通讯》(2025)。期刊信息:《自然通讯》