帕金森病的病理特征之一是大脑中路易体的积累,即由错误折叠的α-突触核蛋白组成的团块。在路易体形成之前,过量的α-突触核蛋白会与神经元轴突内的结构过度结合,阻碍细胞内物质运输,形成“交通堵塞”,这可能为后续病理积累奠定基础。
美国布法罗大学的研究人员近期发现,通过改变α-突触核蛋白与另一种帕金森病相关蛋白——富亮氨酸重复激酶2(LRRK2)之间的相互作用,可以减轻这种运输障碍。相关研究已于上个月发表在学术期刊《分子神经科学前沿》上。
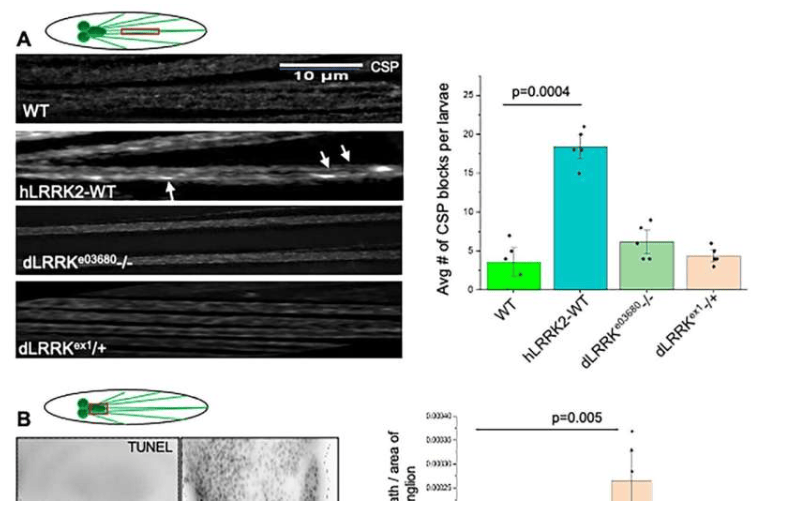
研究人员在果蝇幼虫模型中提高了特定突变型LRRK2蛋白的水平。他们观察到,一种影响LRRK2蛋白WD40结构域的突变,能够削弱α-突触核蛋白与轴突内运输载体结合的能力,从而缓解由α-突触核蛋白过量引起的运输拥堵。该研究的通讯作者、布法罗大学生物科学副教授Shermali Gunawardena博士表示:“这一发现表明,α-突触核蛋白和LRRK2蛋白必须协同作用——并且处于正确的平衡状态,才能被破坏轴突运输。”
研究表明,这种特定的LRRK2 WD40结构域突变本身并不直接影响运输,但其过量表达却能改善α-突触核蛋白造成的堵塞。Gunawardena博士解释道:“突变不一定会杀死蛋白质的功能。它可能夸大它,抑制它,或者导致一个全新的功能。理清这个过程可能很复杂,但在这种情况下,结果表明WD40突变可以抑制LRRK2与α突触核素相互作用的能力,甚至可能在膜内。”
尽管该突变改善了轴突运输,但研究并未发现其对神经元细胞死亡产生直接影响,也尚不清楚是否会影响路易体的最终形成。此项研究的一个重要意义在于,它在两个已知会增加家族性帕金森病风险的基因——SNCA(编码α-突触核蛋白)和LRRK2——之间建立了功能关联。Gunawardena博士指出:“这八个与帕金森病相关的基因似乎都有不同的功能,这使得在最早期阶段真正触发帕金森病的原因变得困难。通过在两者之间找到功能性联系,我们为这种疾病的起源提供了更清晰的图景。” 这项发现为理解帕金森病早期细胞功能障碍提供了新的视角。
出版详情:作者:Piyali Chakraborty等,标题:《帕金森病蛋白亮氨酸重复激酶2与α突触核蛋白在轴突运输过程中的功能关联的遗传证据》,发表于:《分子神经科学前沿》(2026)