美国FDA批准Dawnzera 用于预防罕见遗传病HAE发作
2025-08-22 09:55
收藏
美国食品药品监督管理局周四宣布,批准Ionis Pharmaceuticals研发的Dawnzera药物上市,该药物旨在预防患有罕见遗传病——遗传性血管性水肿(HAE)的成人及12岁以上儿科患者身体各部位出现严重肿胀。消息公布后,Ionis Pharmaceuticals股价在下午交易时段上涨1.1%。

Dawnzera作为一种预防性药物,其化学名称为donidalorsen,通过降低激肽释放酶前体(PKK)蛋白质水平来减少HAE发作,这种蛋白质是导致肿胀和炎症的关键因素。患者可通过每四周或八周一次的皮下注射自行给药,极大提升了用药便利性。Ionis公司表示,Dawnzera将于未来几天在美国市场正式推出,每剂定价为57,462美元。据估计,HAE在美国影响约7,000名患者,现有疗法效果有限,而Dawnzera的获批为这些患者提供了新的治疗选择。此次批准基于后期研究结果,数据显示,与安慰剂相比,每四周服用一次Dawnzera可使HAE每月发作次数减少81%。目前,FDA批准的HAE治疗方法包括预防性治疗和按需用药两类,Dawnzera属于前者。除Dawnzera外,市场上已有日本武田制药的Takhzyro和CSL Behring的Haegarda等预防药物。TD Cowen分析师Yaron Werber指出,Dawnzera的获批引发了市场高度关注,因其为现有疗法效果不佳的患者提供了疗效更高的替代方案。另一项研究显示,Takhzyro每两周服用一次,6.5个月内可使发作次数平均减少87%。韦伯预测,到2032年,Dawnzera的年销售额峰值有望达到5.09亿美元。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

智飞生物冻干乙型脑炎灭活疫苗获临床试验申请受理
2026-01-30

诺和诺德中国区高层周霞萍将离任
2026-01-30
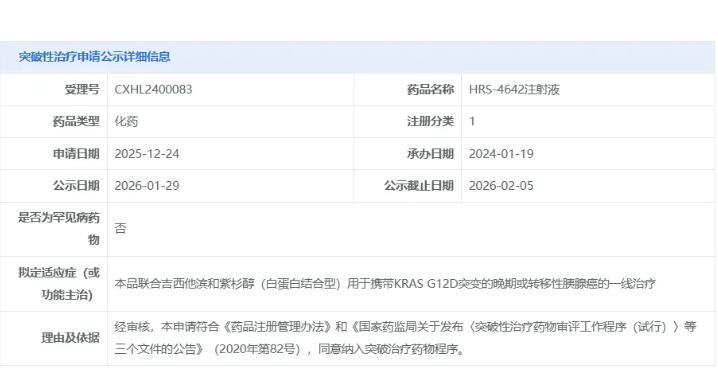
恒瑞医药HRS-4642注射液成全球首个进入III期临床的KRAS G12D抑制剂
2026-01-30

药明生物与思诺达生物达成双特异性抗体开发战略合作
2026-01-30

Mirum制药收购Bluejay Therapeutics推进罕见肝病治疗
2026-01-30
RevBio获FDA批准开展颅骨骨胶临床试验Tetranite
2026-01-30

Tenpoint老花眼滴眼液YUVEZZI获FDA批准并完成2.35亿美元融资
2026-01-30
ENA Respiratory启动INNA‑051鼻喷雾剂二期临床研究
2026-01-30
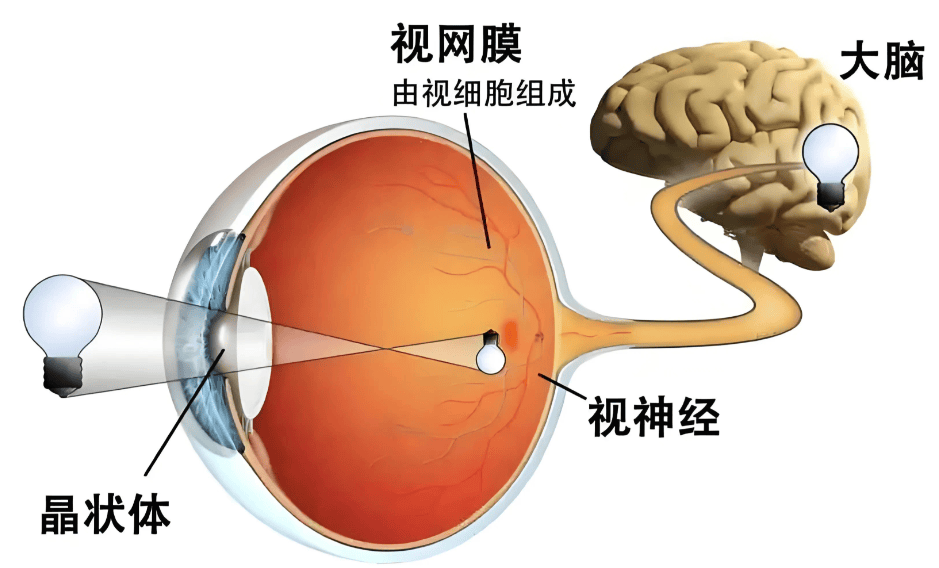
Cortigent公布Orion视觉假体系统基于神经刺激技术的研究成果
2026-01-30

明尼苏达大学与医疗机构签署十年调解协议延续合作
2026-01-30

