FDA拟简化罕见病药物审批 聚焦单组试验与基因治疗
美国食品药品监督管理局(FDA)周三宣布了一项新流程,旨在简化针对罕见疾病的药物审批机制,尤其关注患者群体规模极小(美国境内少于1000人)的基因缺陷相关疾病。根据新规,此类药物可通过单组临床试验数据提交审批申请,前提是需证明现有替代疗法不足以改变疾病进程。FDA强调,审批决策将基于单臂试验的充分研究数据,结合药物在目标部位的作用机制及临床前数据,以确认其有效性。

这一调整是对卫生部长罗伯特·F·肯尼迪今年6月表态的回应。肯尼迪曾明确要求监管机构探索加速罕见病治疗上市的路径,消除市场准入障碍。FDA在声明中指出,患者数量越少,传统多组试验设计越难满足疗效证明要求,因此单组试验数据将成为关键依据。例如,针对超罕见遗传病的药物开发,若能通过单组试验展示明确的治疗效果,即可缩短审批周期。
不过,FDA疫苗和生物制品部门负责人维奈·普拉萨德(Vinay Prasad)的任命引发部分行业担忧。有观察人士认为,其可能提高新药审批标准,包括对加速批准通道的收紧。对此,FDA回应称,新流程将平衡患者需求与安全性要求,确保创新疗法能及时惠及超罕见病群体。目前,该提议已进入公开征求意见阶段,预计将根据反馈进一步修订。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
下一篇:金宝汤明年八月将彻底弃用人工色素
相关推荐

Opus基因疗法启动MERTK相关视网膜色素变性临床试验
2026-01-31

FDA批准Spectrum Dynamics的Veritas.AI核成像降噪平台
2026-01-31
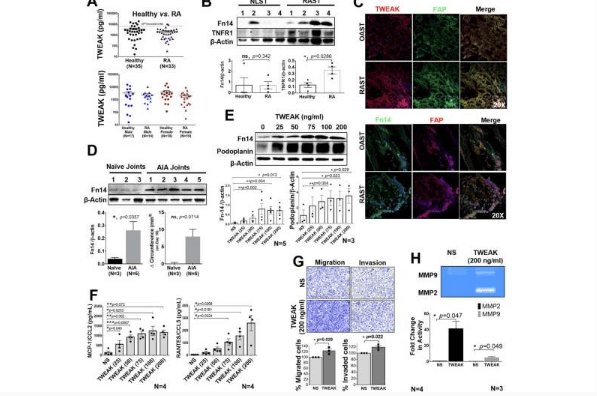
研究发现炎症新通路揭示类风湿关节炎治疗无效原因
2026-01-31

Ardena将瑞典API生产基地剥离给Nanologica
2026-01-31

Libris Innovations任命Ramani Varanasi担任首席执行官推动生物技术创新
2026-01-31

史赛克手持骨科机器人Mako RPS开展首批膝关节手术
2026-01-31

人工智能助力瑞典乳腺癌筛查提升检测效率
2026-01-31
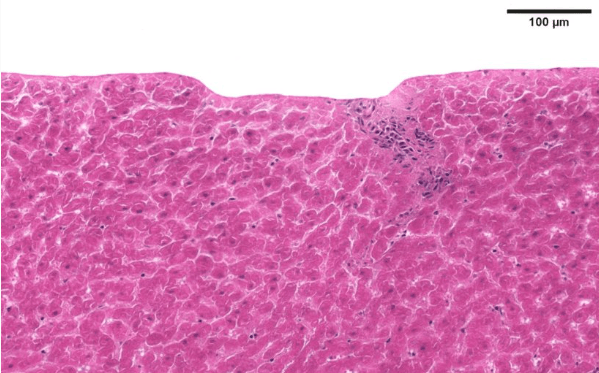
超快激光技术研究实现微米级精度肿瘤切除潜力
2026-01-31

Genyro获授权运用AI驱动DNA书写技术推动生物可编程性
2026-01-31

EMA审查罕见病药物Tavneos数据完整性
2026-01-31

