Robotics系统获FDA批准,推进内腔手术机器人试验
2026-01-16 11:40
收藏
专注于内腔机器人手术技术的EndoQuest Robotics近日宣布,美国食品药品监督管理局(FDA)已批准其PARADIGM关键试验的下一阶段,即最后阶段。这一决定标志着该公司在推动腔内手术(ELS)系统商业化进程中迈出了重要一步。
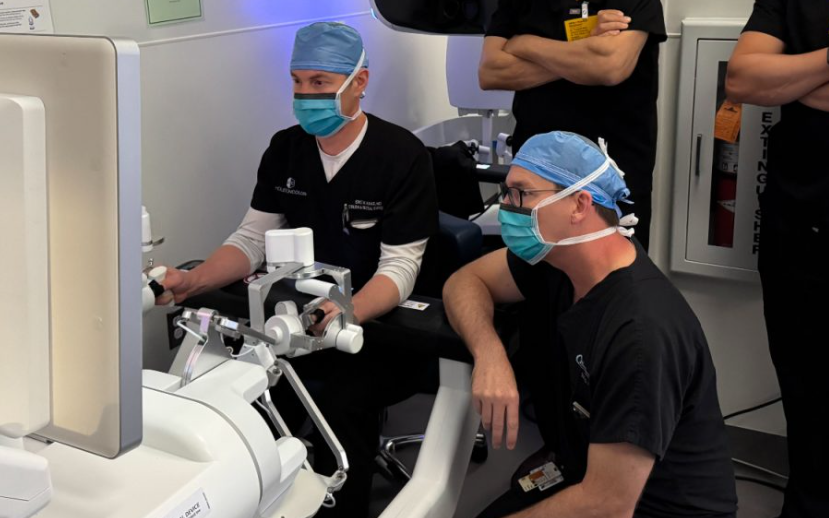
PARADIGM试验,全称为胃肠医学机器人辅助设备的前瞻性评估,是一项试验性器械豁免(IDE)研究。其核心目标是评估EndoQuest的ELS系统在内窥镜黏膜下层夹层(ESD)手术中的应用效果。FDA的批准基于ELS系统对首批受试者安全性结果的积极报告,为EndoQuest在美国市场推广该系统的新分类申请铺平了道路。
首批手术由腔内手术领域的权威专家完成,包括胃肠病专家深见纪夫博士、结直肠外科医生Matthew Albert博士和Eric Haas医生。Haas医生表示,ELS系统让他能够以外科手术般的精准度完成解剖和缝合,解决了传统经肛门技术难以处理的问题。他评价道:“这个平台是我机器人技能的自然延伸,我期待继续探索它如何拓展微创结直肠手术的可能性。”
PARADIGM试验将招募50名受试者,在美国五大医疗机构进行,包括HCA Healthcare、梅奥诊所、克利夫兰诊所、布莱根妇女医院和AdventHealth。试验将评估ELS系统在机器人ESD手术中切除直肠和乙状结肠病灶的效果。
EndoQuest首席执行官爱德华多·福内斯卡表示:“每一例手术都是我们向定义新外科类别迈进的一步,我们将继续巩固在内窥镜手术室中建立机器人技术的领先地位,为患者、医生和医疗系统创造价值。”上个月,公司还宣布与NVIDIA合作,集成其IGX Thor企业级平台,以推动下一代机器人系统的商业化进程。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
下一篇:珠海铁路枢纽总图方案将启动论证
相关推荐
安天基因Xpovio在韩国新增多发性骨髓瘤治疗报销适应症
2026-03-03

Aurobindo Pharma加速布局印度青霉素-G市场
2026-03-03
ImmunityBio携ANKTIVA进军中东及北非癌症治疗市场
2026-03-03

ELEVIDYS在日本商业化上市,用于治疗杜氏肌营养不良症
2026-03-03

Iza-bren三期临床试验中期分析结果积极,为乳腺癌提供新方式
2026-03-03

中源协和子公司获中国首款飞行时间质谱法肿瘤伴随诊断试剂盒注册证
2026-03-02

心脉医疗Hector®胸主动脉支架获美国FDA突破性认定
2026-03-02

默沙东贝组替凡两项III期研究数据公布
2026-03-02
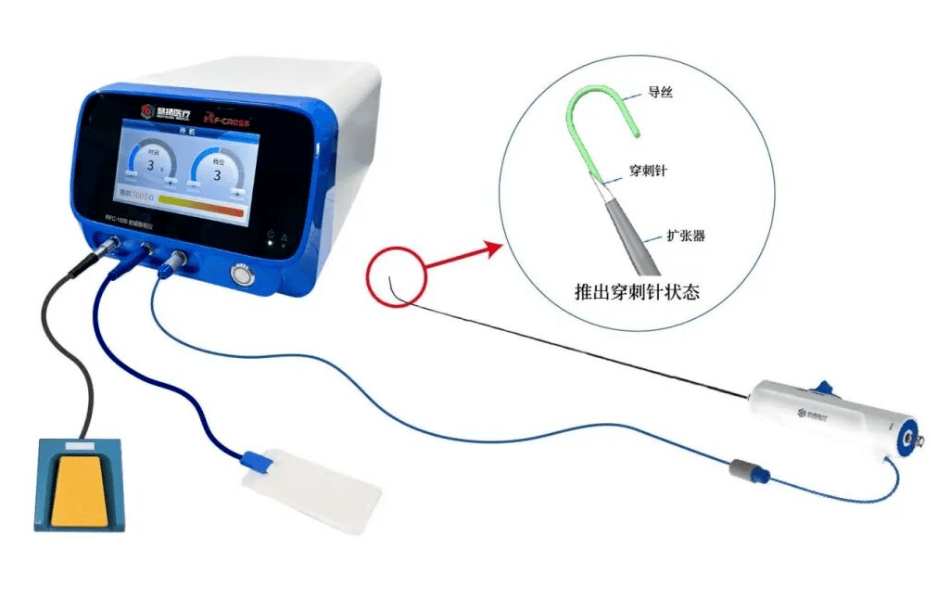
慧扬医疗RF-cross®射频房间隔穿刺系统获批,推动中国心脏介入手术升级
2026-03-02
AI基础模型BrainIAC在脑部MRI诊断中的潜力分析
2026-03-02

