Wugen细胞疗法Sofi-cel获FDA突破性认证
2026-01-22 16:23
收藏
美国生物技术公司Wugen近日宣布,其研发的CAR-T细胞疗法soficabtagene geleucel(Sofi-cel)获得美国食品药品监督管理局(FDA)突破性疗法认证。这一认证旨在加速针对严重或危及生命疾病的新疗法开发,适用于早期临床数据显示较现有方案有显著改善的治疗手段。Sofi-cel作为潜在首创的现成抗CD7异体CAR-T疗法,正被开发用于治疗复发或难治性T细胞急性淋巴细胞白血病(T-ALL)和T细胞淋巴细胞淋巴瘤(T-LBL)患者。
FDA的决策基于一项全球一、二期临床研究数据,该研究评估了Sofi-cel在复发或难治性T-ALL/T-LBL患者中的疗效。目前,该疗法正在关键的二期T-RRex试验中接受进一步评估,这是一项单臂研究,旨在确认其在目标患者群体中的安全性和有效性。此前,细胞疗法Sofi-cel已获得FDA多项监管认证,包括再生医学先进疗法(RMAT)、快速通道、孤儿药和罕见儿科疾病认证,并在欧盟获得同一适应症的优先药品(PRIME)认证。
细胞疗法Sofi-cel采用异基因供体来源的T细胞,通过CRISPR/Cas9基因编辑技术去除CD7和TRAC基因,防止CAR-T细胞自相残杀并降低移植物抗宿主病风险。与自体CAR-T疗法相比,这种设计避免了恶性细胞污染风险,且可提前制备、随时使用,显著缩短治疗等待时间。目前,关于Sofi-cel在复发或难治性T-ALL/T-LBL中的关键全球研究正在进行中,更多信息可通过ClinicalTrials.gov(标识号NCT06514794)查询。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

美国Cognex与Ascential公司展示AI视觉系统在医疗器械质量控制中的创新应用
2026-03-10

德国医疗设备知识单元协会发布医疗器械数字技术文档统一数据模型DIN SPEC 91509
2026-03-10

East-West Manufacturing公司在哥斯达黎加扩展医疗器械业务,受益于自贸区政策与可持续能源
2026-03-10

美国Midland Industries收购ISM以扩大医疗和工业产品组合
2026-03-10

TelkomMetra剥离AdMedika集团,Fullerton Health用于数字医疗新增长
2026-03-10

Calidi Biotherapeutics完成600万美元公开发行,推进基因药物研发
2026-03-10

欧洲行为健康管理解决方案市场兴起,人工智能驱动个性化心理健康服务变革
2026-03-10
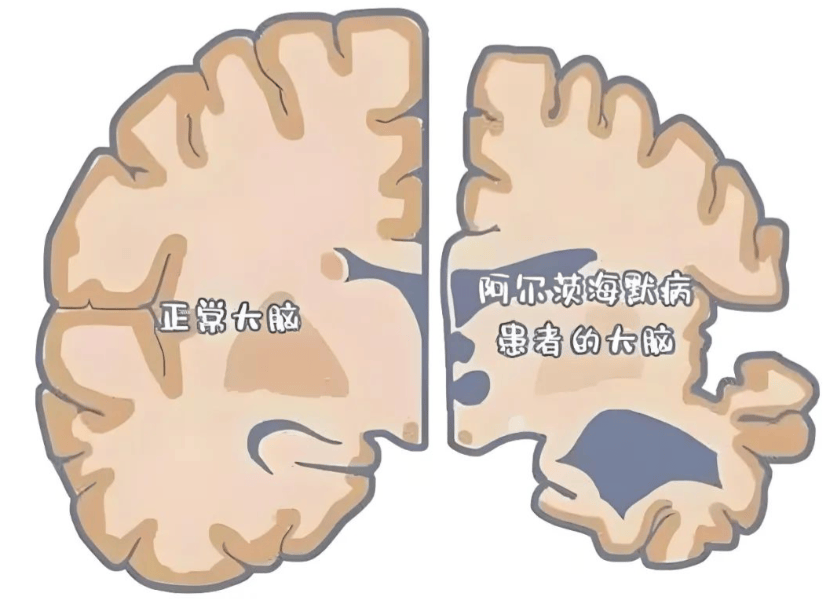
Codex Genetics与C2N Diagnostics在中国香港推出PrecivityAD2血液检测,用于阿尔茨海默病诊断
2026-03-10

英国贝尔法斯特Educational Voice推出医疗保健和企业动画服务页面
2026-03-10

美国医疗保健领域人工智能平台提升人口健康管理效率
2026-03-10
