生物类似药进军中国视网膜疾病治疗领域
2026-01-28 10:40
收藏
视网膜疾病治疗领域正经历产业变革,生物类似药逐步打破原研药垄断,形成“原研药+生物类似药”的多元竞争格局,为常见且治疗成本高昂的致盲性视网膜疾病提供全新治疗选择。
2021年,美国FDA批准韩国仁川三星生物制剂公司研发的Byooviz(雷珠单抗 - nuna),此后多款雷珠单抗生物类似药相继上市。中国齐鲁制药的安卓明®(雷珠单抗眼内注射液)作为国内首款获批的雷珠单抗生物类似药,通过国际多中心III期临床试验验证了与原研药的等效性,还登陆欧盟市场。2023年底,齐鲁制药的卓初明®(阿柏西普眼内注射液)获批上市,成为中国首个获批的阿柏西普生物类似药。2025年11月,博安生物研发的博优景®获中国国家药监局批准,用于治疗新生血管性年龄相关性黄斑变性和糖尿病性黄斑水肿,成为中国第二款同类产品。印度班加罗尔的Biocon生物制剂公司与美国纽约的Regeneron公司达成和解,其研发的Yesafili(阿柏西普 - jbvf)计划于2026年底前或根据特定条款提前在美国上市。
生物类似药虽无法与原研生物制剂完全一致,但结构、纯度和效价极为相似,疗效相当。其研发过程比原研生物制剂更快、成本更低。首款雷珠单抗生物类似药上市时价格较参比药物降低40%,平均销售价格差异约为31.3%,成本节约潜力显著。不过,生物类似药在眼科领域推广起步缓慢,2023年使用率仅为3%,2024年约10%,部分原因是医生思维惯性,更倾向于选择疗效最优方案。美国视网膜专科医生还担忧保险公司推行限制性阶梯治疗方案。
随着更多生物类似药加入治疗工具箱,视网膜疾病治疗格局将发生变化。医生需做好准备,深入了解生物类似药,向患者清晰解释,关注医保动态,监测患者疗效,以实现平稳过渡。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

普洛药业与德睿智药签署战略合作用于创新药CDMO项目
2026-01-28

恒瑞医药累计回购907.37万股,耗资6.05亿元推进员工持股计划
2026-01-28

亚行与药兜签署贷款协议用于中国院外药品供应链升级
2026-01-28

中国国家药监局综合司关于《采用脑机接口技术的医疗器械 范式设计与应用规范 运动功能重建》等2项医疗器械行业标准立项的通知
2026-01-28

瑞科生物获证监会备案通知书,境内未上市股份拟全流通
2026-01-28

弼领生物获超2亿元B轮融资,加速纳米偶联药物研发与产业化
2026-01-28
恒瑞医药HRS-5346片获突破性治疗认定用于脂蛋白(a)升高治疗
2026-01-28
生物类似药进军中国视网膜疾病治疗领域
2026-01-28
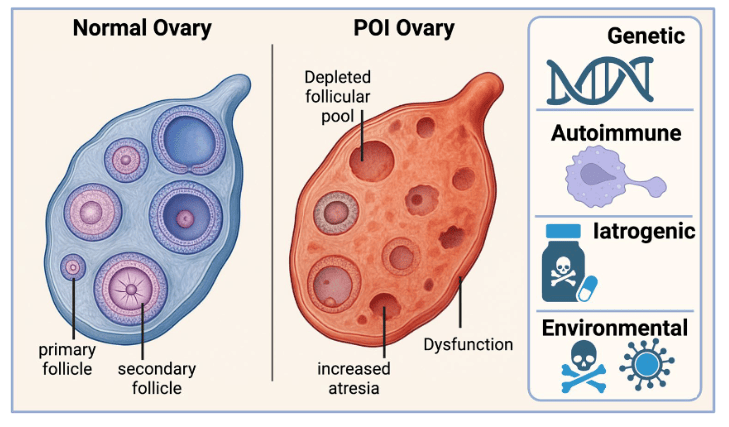
干细胞治疗为卵巢早衰患者带来新希望
2026-01-28

艾伯维ABBV - 706启动SCLC首个III期试验
2026-01-28

