长春高新子公司伏欣奇拜单抗注射液临床试验申请获受理
2026-01-29 11:03
收藏
长春高新1月28日晚发布公告,其控股子公司长春金赛药业有限责任公司近日收到中国国家药品监督管理局的《受理通知书》,伏欣奇拜单抗注射液的境内生产药品注册临床试验申请获得受理。伏欣奇拜单抗是金赛药业自主研发的一款全人源抗白介素-1β(IL-1β)单抗,拟用于治疗非感染性葡萄膜炎。该药物通过特异性阻断IL-1β与受体结合,抑制下游信号通路活化,有望为非感染性葡萄膜炎患者提供新的治疗选择。

非感染性葡萄膜炎是一种重要的致盲性眼病,全球年发病率和患病率均较高,构成严重公共卫生负担。目前,该适应症获批的生物制剂有限,且部分患者应答不佳或不耐受,因此对新机制药物存在需求。长春高新子公司新药伏欣奇拜单抗注射液的临床试验申请受理,将推动其针对非感染性葡萄膜炎人群的临床开发进程。
此外,伏欣奇拜单抗注射液(水剂)已获批开展子宫内膜异位症的临床试验,其用于急性痛风性关节炎适应症的上市申请也已获得受理。注射用伏欣奇拜单抗(粉剂)同样在多个适应症领域取得进展。长春高新表示,如临床试验申请进展顺利,将有助于公司拓宽业务结构、优化产品结构,并丰富战略领域产品线布局,提升核心竞争力。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

Gilead Sciences药物获NCCN指南最高推荐用于特定转移性乳腺癌治疗
2026-01-29
Cellares获2.57亿美元D轮融资,推进细胞治疗平台建设
2026-01-29

Sensorion获赛诺菲领投6000万欧元融资推进基因治疗项目
2026-01-29

韩美制药与墨西哥Sanfer签署糖尿病药物独家分销协议
2026-01-29

2026分子胶药物研发国际研讨会在中国上海成功举办
2026-01-29

Pinnacle Food全资子公司与Bioboost签署生物技术研究合作协议
2026-01-29
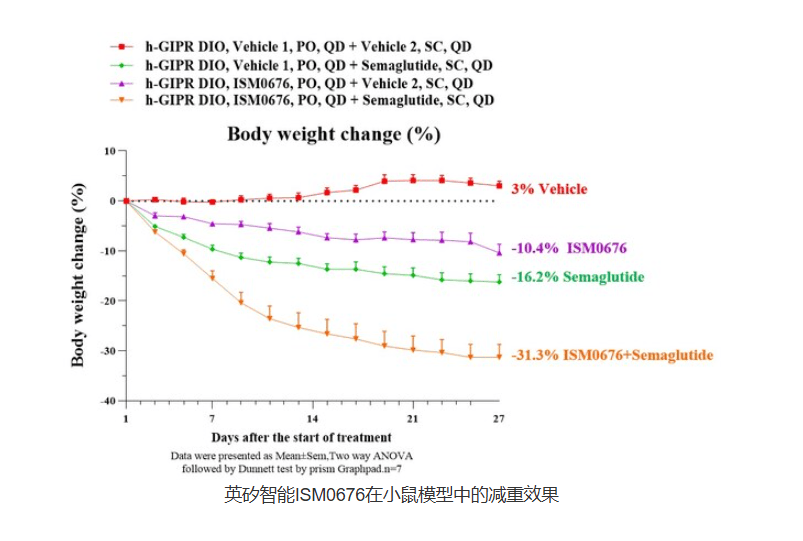
英矽智能AI赋能GIPR拮抗剂ISM0676成临床前候选化合物
2026-01-29

药明生物与生诺医药达成合作,加速创新双抗开发和生产
2026-01-29

盟科药业抗菌新药MRX-5片获美国FDA临床试验许可
2026-01-29

长春高新子公司伏欣奇拜单抗注射液临床试验申请获受理
2026-01-29

