加州大学圣巴巴拉分校、加州大学旧金山分校和匹兹堡大学的研究人员开发了一种从零开始设计酶的全新工作流程,为更高效、更强大、更环保的化学反应铺平了道路。这种新方法允许设计人员将各种理想特性组合成天然催化剂,用于从药物开发到材料设计的一系列应用。
这项研究发表在《科学》杂志上,是加州大学旧金山分校 DeGrado 实验室、加州大学圣塔芭芭拉分校杨实验室和匹兹堡大学刘实验室合作的成果。
“如果人们能够从头开始设计出非常高效的酶,那么就可以解决许多重要的问题,”该论文的资深作者、加州大学圣塔芭芭拉分校化学教授杨阳说。
例如,酶的从头设计可以克服天然催化剂在功能和稳定性方面的限制,而不会失去其固有的选择性和效率。
“对于基础研究,化学家和生物学家一直希望能够从头开始设计酶,”杨补充道。
定制蛋白质催化剂
催化剂,无论是生物催化剂还是合成催化剂,都是化学反应中的主力。它们负责促成和加速改变目标分子结构的反应。杨教授认为,酶尤其被称为“自然界的特权催化剂”,因为这些蛋白质在催化反应方面具有极高的选择性和效率。
然而,天然酶往往在狭窄的条件下发挥作用,只对特定环境中的某些分子有利。为了将生物催化能力赋予更多分子,科学家们正在转向从头蛋白质设计,这是一种自下而上的方法,利用氨基酸构建块来创建具有特定结构和功能的蛋白质。
从头蛋白质相对较小的体积提供了相对于大多数酶有利的效率;其优异的热稳定性和有机溶剂稳定性可以允许更宽的温度范围和高达 60% 的有机溶剂,并且可以使用各种辅助因子,包括自然界中不存在的辅助因子,进一步优化蛋白质以获得所需的结果。
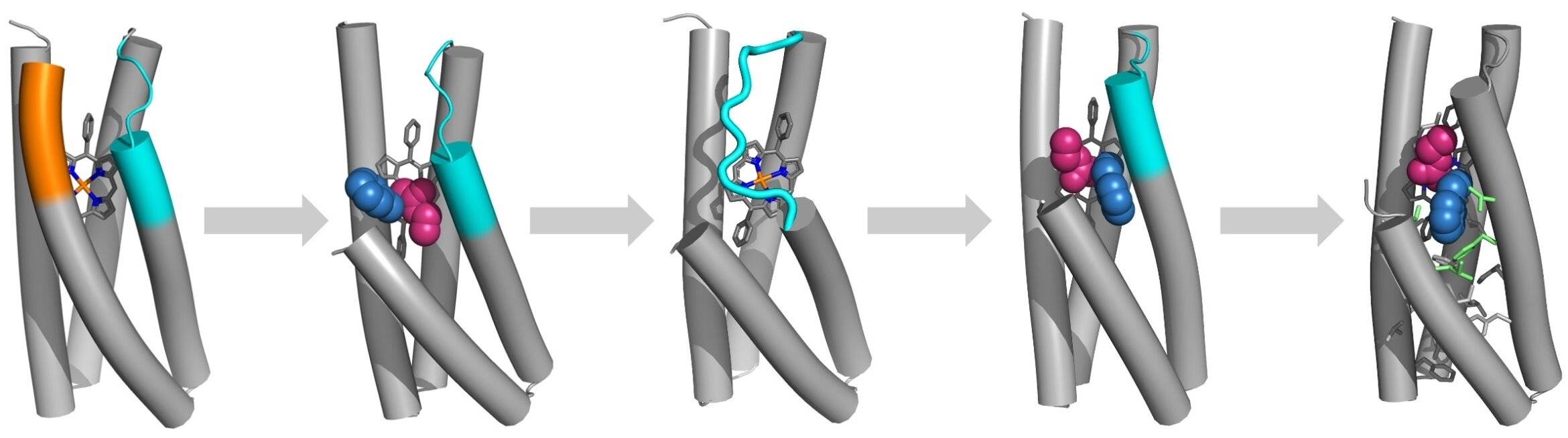
杨教授在谈到研究人员的概念验证时表示:“通过与加州大学旧金山分校的 Bill DeGrado 团队和匹兹堡大学的 Peng Liu 团队合作,我们有一个工作流程,可以将非常简单和微型的螺旋束蛋白转化为非常高效和选择性极高的酶,以催化合成有用的反应。”
杨教授表示,该项目需要利用从头蛋白质设计来创造能够形成碳-碳或碳-硅键的酶,而“目前还缺乏有效的天然酶”。
该团队以螺旋束蛋白为框架,利用最先进的人工智能方法设计蛋白质结构下的氨基酸序列,并赋予其所需的功能和特性,从而将螺旋束转化为酶。
杨教授在谈到初步结果时表示:“早期的变体是合理的催化剂,但它们并非最佳,因为效率和选择性都比较低。” 基于所得蛋白质的X射线晶体学分析,他们发现结构中出现了一个“无序环”,而原本应该是有序的螺旋。第二轮设计采用了环搜索算法,最终在10个设计中选出了4个,并获得了高活性和优异的立体选择性。
“换句话说,尽管基于人工智能的蛋白质设计方法非常有用,但要想获得非常好的催化剂,我们仍然必须使用我们的内部算法和化学直觉来以正确的方式完成所有事情,”杨说。
该项目的成功表明,从头蛋白质设计可以成为催化领域的有力工具,可以为化学家提供更高效、更具选择性的反应,以及获得天然酶或小分子合成催化剂不易获得的产品。
杨说: “如果你真正理解了设计原理,那么你就可以构建一种蛋白质催化剂,使用任何你想使用的辅助因子,并在水(最环保的溶剂)作为反应介质中实现具有挑战性的转化。”
杨实验室的进一步工作将与 DeGrado 实验室和刘实验室合作,探索使用更简单、更小但同样活跃的从头酶来模拟天然酶功能的方法,并生成通过自然界中未知的机制运作的从头酶。
本文的研究由 Kaipeng Hou、Wei Huang、Miao Qui、Thomas H. Tugwell、Turki Alturaifi、Yuda Chen、Xingjie Zhang、Lei Lu 和 Samuel I. Mann 进行。
更多信息: 侯凯鹏等,《从头设计含卟啉蛋白质作为高效立体选择性催化剂》,《科学》(2025)。期刊信息: Science













 京公网安备 11010802043282号
京公网安备 11010802043282号