康方生物合作方Summit提交依沃西单抗美国上市申请
2026-01-13 09:19
收藏
1月12日,康方生物的海外合作伙伴Summit Therapeutics对外公布,其已于2025年第四季度正式向美国食品药品监督管理局(FDA)递交了PD-1/VEGF双抗Ivonescimab(中文名:依沃西单抗注射液)的生物制品许可申请(BLA)。申请旨在推动依沃西单抗联合化疗方案,用于EGFR突变型非小细胞肺癌患者的二线及以上治疗。

申请依据来自全球III期HARMONi试验的总体结果。数据显示,依沃西单抗联合化疗在延长患者无进展生存期方面表现突出,且安全性可控。康方生物的海外合作伙伴Summit方面表示,若申请按原样被受理,根据FDA标准的审查流程,预计将在2026年第四季度获得审批结果。
依沃西单抗作为全球首个PD-1/VEGF双特异性抗体药物,其创新设计可同时阻断PD-1和VEGF通路,通过协同作用增强抗肿瘤效果。此前,该药物已在中国获批用于特定非小细胞肺癌的治疗,并展现出良好的疗效与安全性。康方生物的海外合作伙伴Summit提交BLA申请,体现了国际市场对依沃西单抗临床价值的认可,也为全球EGFR突变型非小细胞肺癌患者提供了新的治疗选择。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐
安天基因Xpovio在韩国新增多发性骨髓瘤治疗报销适应症
2026-03-03

Aurobindo Pharma加速布局印度青霉素-G市场
2026-03-03
ImmunityBio携ANKTIVA进军中东及北非癌症治疗市场
2026-03-03

ELEVIDYS在日本商业化上市,用于治疗杜氏肌营养不良症
2026-03-03

Iza-bren三期临床试验中期分析结果积极,为乳腺癌提供新方式
2026-03-03

中源协和子公司获中国首款飞行时间质谱法肿瘤伴随诊断试剂盒注册证
2026-03-02

心脉医疗Hector®胸主动脉支架获美国FDA突破性认定
2026-03-02

默沙东贝组替凡两项III期研究数据公布
2026-03-02
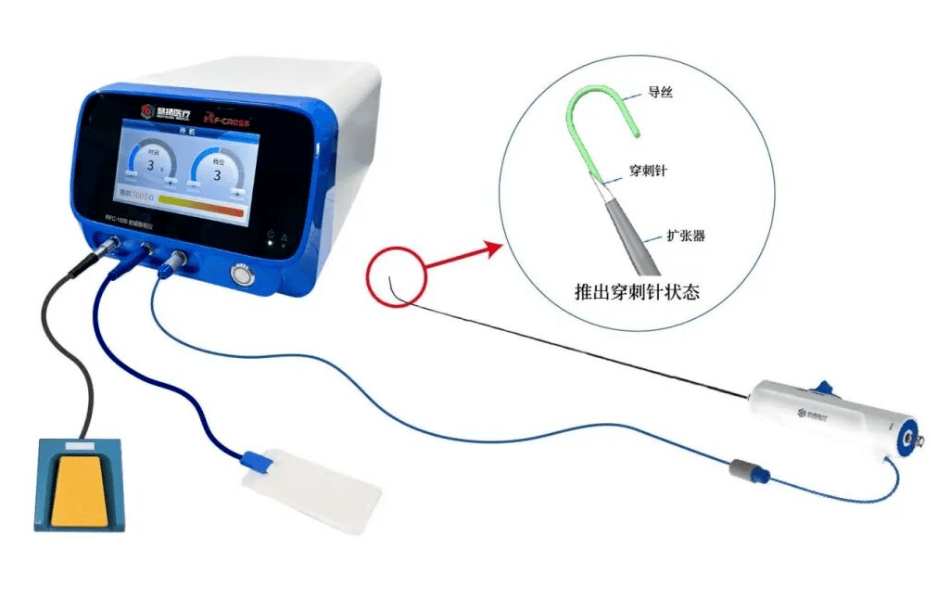
慧扬医疗RF-cross®射频房间隔穿刺系统获批,推动中国心脏介入手术升级
2026-03-02
AI基础模型BrainIAC在脑部MRI诊断中的潜力分析
2026-03-02

