中国华中科技大学同济医院团队揭示孕烯醇酮驱动肿瘤免疫逃逸新机制
2026-02-03 09:08
收藏
近日,中国华中科技大学同济医学院附属同济医院王桂华与胡俊波团队在《Cell Metabolism》发表研究论文,揭示类固醇代谢物孕烯醇酮(P5)通过调控内源性逆转录病毒(ERV)表达,成为驱动肿瘤免疫逃逸的关键因子。研究首次发现,交配剥夺等行为因素可通过激活下丘脑-垂体-肾上腺轴(HPA轴),诱导肾上腺分泌P5并积聚于肿瘤组织,为“行为-神经内分泌-表观遗传-免疫”跨系统调控轴提供关键证据。
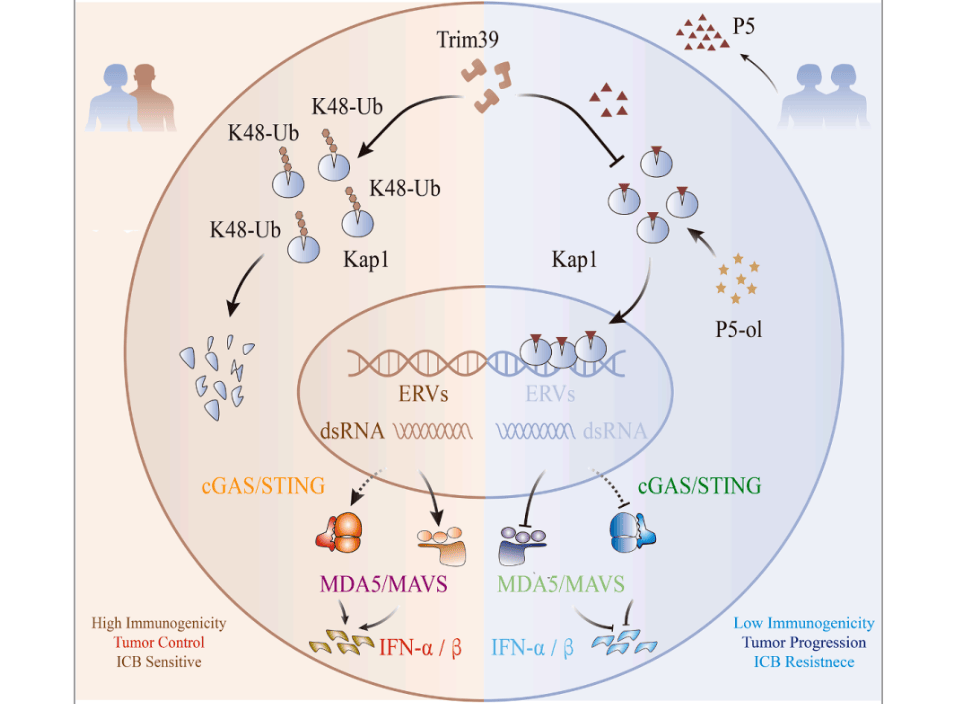
研究通过小鼠模型发现,P5通过稳定转录抑制因子Kap1,阻断其泛素化降解,导致Kap1异常积聚并沉默ERV表达。ERV的沉默熄灭了肿瘤细胞产生I型干扰素(IFN-I)的天然免疫“火种”,使肿瘤实现免疫隐身。进一步分析人类结直肠癌及乳腺癌数据库显示,P5高水平与患者预后不良显著相关。基于此,团队开发了P5竞争性抑制分子P5-ol,其可打破P5对Kap1的稳定作用,重新激活ERV表达并诱导天然免疫响应。在多种小鼠模型中,P5-ol联合PD-1抗体治疗显著增强疗效,将“冷肿瘤”转化为“热肿瘤”。
该研究不仅阐明了P5在肿瘤免疫逃逸中的核心作用,还为开发新型免疫干预策略提供理论依据。团队提出的P5-ol分子有望成为提升实体瘤免疫治疗效果的First-in-class靶点。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

中国上海励楷科技获D轮融资,加速神经介入器械布局
2026-02-03

Fidēs亮相2026年SCOPE峰会,医用影像驱动早期临床开发创新
2026-02-03

中国生物制药创新加速发展,全球评估标准同步提升
2026-02-03

通过转化科学与政策推动弥合亚洲癌症研究差距
2026-02-03

En Carta Diagnostics的EC Pocket Lyme检测获得FDA突破性设备认定
2026-02-03
HER2阳性转移性胃食管腺癌一线治疗创新需求与进展
2026-02-03

ALK公司EURneffy获CHMP积极意见用于儿童过敏性休克治疗
2026-02-03

中国医药子公司获达比加群酯胶囊药品注册证书
2026-02-03

亿帆医药子公司获维生素K1注射液药品注册证书
2026-02-03
HERIZON-GEA-01研究数据公布,HER2阳性胃癌治疗迎突破
2026-02-03

