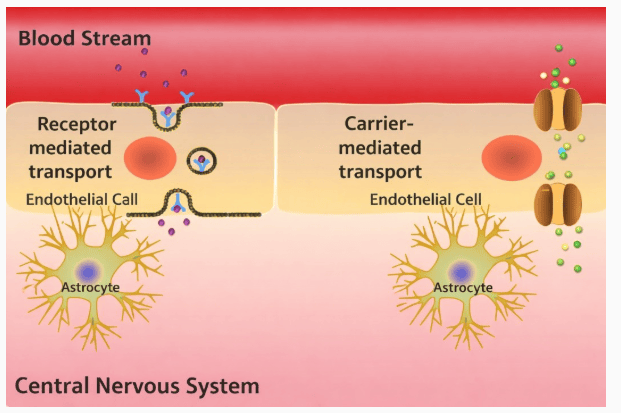
美国食品药品监督管理局(FDA)已接受阿斯利康与第一三共共同研发的Datroway(datopotamab deruxtecan)补充生物制品许可申请,并授予优先审评资格。该药物拟用于一线治疗不适合PD-L1抑制剂治疗的不可切除或转移性三阴性乳腺癌成年患者。长期以来,化疗是该患者群体唯一获批的治疗选择,而Datroway有望成为新的标准疗法。FDA通常将优先审评资格授予在安全性或有效性方面可能显著优于现有疗法的药物。

大约70%的转移性三阴性乳腺癌患者因肿瘤不表达PD-L1或其他临床因素不符合免疫治疗条件。此次申请正在“奥比斯项目”框架下进行审评,该国际协作机制允许参与方同步提交和审评肿瘤药物,旨在通过简化跨国审评流程,加速有效疗法惠及患者。阿斯利康肿瘤血液学研发执行副总裁Susan Galbraith表示:“在TROPION-Breast02试验中,Datroway是唯一与化疗相比显著改善总生存期的药物,考虑到试验入组了疾病高度侵袭性的患者,这一结果尤为突出。优先审评资格凸显了数据的影响力,奥比斯项目下的审评则体现了各方尽快将Datroway带给全球患者的共同承诺。”根据相关法案,最终监管决定预计于2026年第二季度公布。
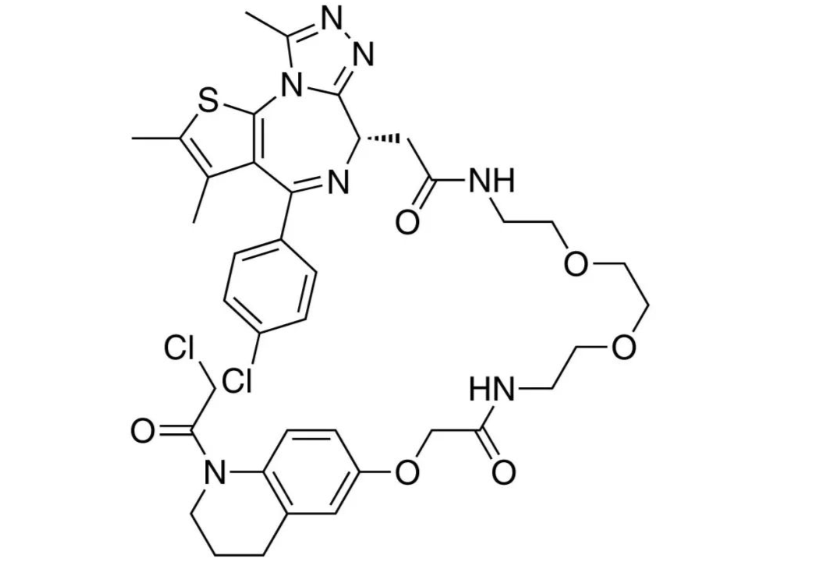
Datroway是一种靶向TROP2的DXd抗体药物偶联物,由人源化抗TROP2单克隆抗体通过可裂解连接子与拓扑异构酶I抑制剂有效载荷偶联而成。在TROPION-Breast02 III期试验中,与化疗相比,Datroway将中位总生存期显著延长了五个月,并将疾病进展或死亡风险降低43%。第一三共全球研发负责人Ken Takeshita指出:“Datroway可能成为首个在一线治疗中显著延长总生存期、并使无进展生存期近乎翻倍的药物,为无法接受免疫治疗的转移性三阴性乳腺癌患者提供迫切需要的选择。”该ADC的临床开发计划已涵盖超过20项针对各类实体瘤的试验,展现了其平台技术的拓展潜力。
同期,阿斯利康另一款药物度伐利尤单抗在欧洲取得进展。欧洲药品管理局人用药品委员会已推荐其用于可切除早期及局部晚期胃与胃食管结合部癌成年患者,若获批将成为欧盟首个针对该群体的免疫疗法围手术期方案。该方案采用新辅助度伐利尤单抗联合FLOT化疗,随后辅助治疗及单药维持。MATTERHORN III期试验数据显示,该方案将疾病进展、复发或死亡风险降低29%。Vall d'Hebron大学医院肿瘤内科主任Josep Tabernero表示:“这一建议标志着欧盟早期胃及胃食管结合部癌治疗迈出重要一步,既往患者即使接受手术和化疗仍面临高复发风险。基于度伐利尤单抗的围手术期方案首次在该领域显著延长生存期,有望成为新的标准治疗。”联合用药安全性特征与各药物已知数据一致,手术完成率与单纯化疗相当。