MHRA发布临床试验体外诊断提交新规,2026年4月起实施
2026-02-05 10:23
收藏
英国药品和医疗产品监管局(MHRA)近日宣布,将规范临床试验中体外诊断(IVD)和伴随诊断(CDx)的审查流程。根据新规,自2026年4月28日起,申办者必须在研究性药品临床试验(CTIMP)提交材料中提供所用体外诊断设备的详细信息,取代此前零散的指南要求。若不遵守新规,相关试验将无法继续进行。

目前,英国的临床试验需经过MHRA和伦理委员会的并行评估。MHRA临床试验负责人Kingyin Lee在网络研讨会上表示:“我们计划将体外诊断设备评估纳入这一联合审查流程。这是20年来临床试验法规最重要的更新,旨在提升患者安全、增强试验透明度,并构建一个简化、灵活且相称的监管框架。”
根据新要求,若体外诊断设备已获得UKCA或CE认证,并在试验中按市场准入要求使用,申办者需通过综合研究申请系统(IRAS)在CTIMP提交中说明相关细节。若未获得认证,则需提交健康研究所豁免(HIE)。此外,在北爱尔兰使用的体外诊断设备必须注明其欧盟医疗器械法规(EU MDR)指定。
除上述信息外,申办者还需通过IRAS提交分析性能研究报告或表格摘要。MHRA低风险评估经理Anthony Carter指出:“作为体外诊断审查流程的一部分,我们将设置最长七天的验证窗口。未提供所需体外诊断文件的申请将被视为无效,以确保联合审查流程顺利进行。”Carter还强调,申办者必须在CTIMP提交中包含封面信,明确说明试验中使用了体外诊断设备,以保障系统流程的规范性。
MHRA表示,通过将体外诊断评估与临床试验审查整合并提供单一结果,新框架有望减少重复工作,提升使用体外诊断的临床试验的透明度。体外诊断在临床试验中的作用日益凸显,可用于样本检测、患者分层、治疗反应监测等多个环节,为临床决策提供关键数据支持。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

阳狮集团推进“与癌共职”计划,加速人工智能医疗
2026-02-05
Solis乳腺影像服务CEO更替,丽莎阿什比接任推动女性健康诊断平台发展
2026-02-05

西班牙加强药品战略储备应对阿片类药物过量危机
2026-02-05

Runeasi获100万欧元融资加速人工智能医疗发展
2026-02-05
超声波凝胶垫革新医疗成像:罗望子籽胶固态垫提升检查体验
2026-02-05
HELZ2蛋白质调控胆固醇释放机制研究取得新进展
2026-02-05

直升机紧急医疗服务提升危重伤者生存率
2026-02-05

Endospan发布NEXUS主动脉弓覆膜支架系统一年期临床研究数据
2026-02-05
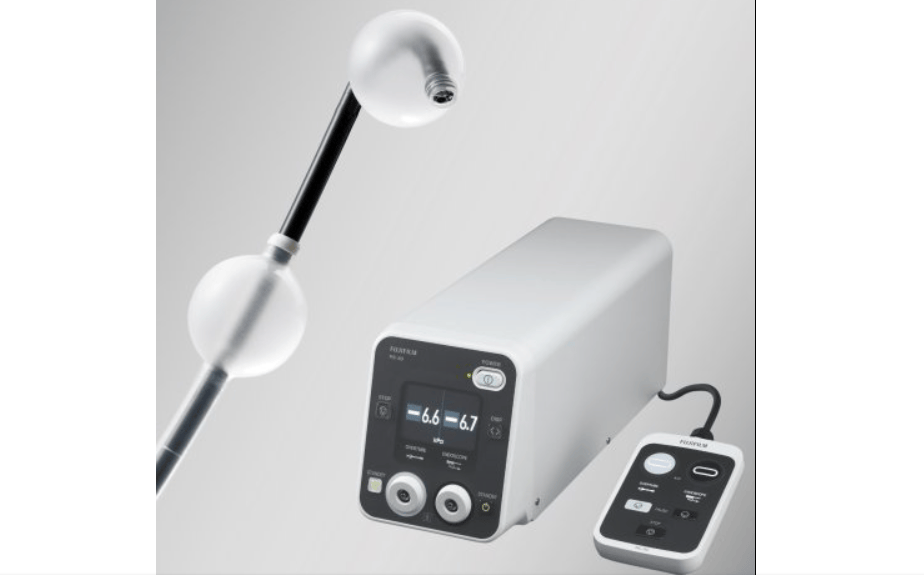
富士胶片EN-840T内窥镜实现球囊控制集成升级
2026-02-05

Dewpoint Therapeutics启动药物针对胃癌的1a/2a期临床试验
2026-02-05

