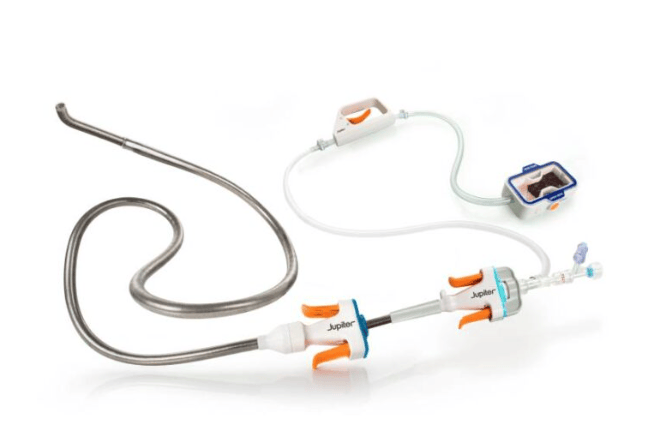
MEDIPOST近日宣布,美国食品药品监督管理局已正式批准其脐带血来源异体间充质干细胞疗法Cartistem开展三期临床试验。这项批准为Cartistem治疗膝骨关节炎在美国和加拿大推进后期临床研究铺平了道路。
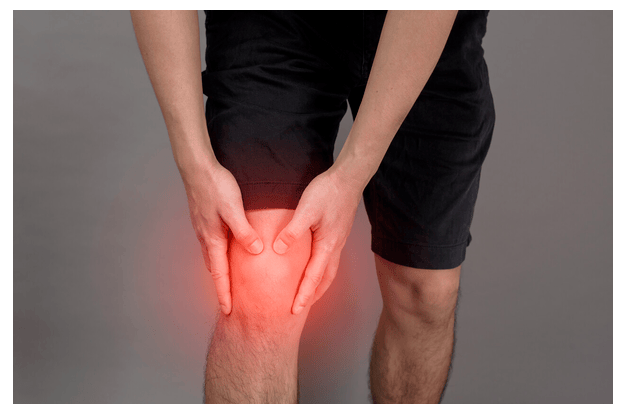
该临床试验将采用随机双盲设计,旨在对比评估Cartistem与手术软骨清创术的疗效差异。研究计划在美国和加拿大超过60个临床中心同步开展,预计纳入数百名被诊断为中度至重度膝骨关节炎的患者,其病情严重程度对应Kellgren-Lawrence分级2至3级。所有入组膝骨关节炎患者将被随机分配至Cartistem治疗组或对照组,并在干预后接受为期两年的随访观察。
MEDIPOST表示,公司已完成试验启动前的各项准备工作,计划于2026年第一季度为首位受试者施用Cartistem。这项研究旨在验证Cartistem作为潜在疾病修饰性骨关节炎药物的有效性与安全性,核心评估指标聚焦于其促进软骨再生的能力。
Cartistem在韩国市场已有超过十年的应用历史。该产品于2012年获得韩国食品药品安全部的上市许可,长期积累的手术案例与真实世界数据为其安全性和软骨再生效果提供了支持。除北美地区外,MEDIPOST也在积极拓展其他国际市场。公司目前正与多家制药及生物技术企业进行业务洽谈,寻求在美国、中国等市场建立合作伙伴关系。
在日本,Cartistem的三期临床试验已经完成,最终临床研究报告正在整理中,研究结果预计将于今年第二季度对外公布。MEDIPOST计划在今年下半年向日本监管机构提交上市申请,目标是在2027年获得批准。为推进日本市场商业化,公司已于去年12月与帝国制药签署独家销售权协议。根据协议条款,帝国制药将支付118亿韩元(约合813万美元)的首付款,后续还将根据监管里程碑和长期销售表现支付额外费用。