专注于脑部疾病诊疗的人工智能公司Neurophet宣布,其软件解决方案Neurophet AQUA AD Plus已获得美国食品药品监督管理局(FDA)的510(k)许可。该产品是一款用于阿尔茨海默病临床评估的综合神经影像分析工具,这是该公司第三次获得FDA批准。
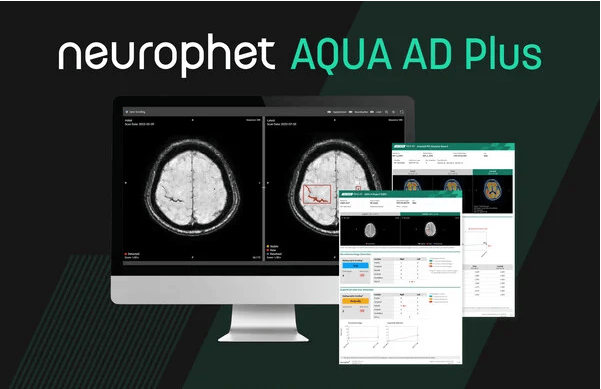
此前,Neurophet已有两款软件获得FDA许可,包括脑神经退行性疾病影像分析软件Neurophet AQUA和PET图像定量分析软件Neurophet SCALE PET。此次获批进一步验证了该公司核心产品组合在全球监管标准下的安全性和有效性。
Neurophet AQUA AD Plus旨在支持阿尔茨海默病全程护理中的影像评估。该软件可对MRI和PET图像进行定量分析,实现大脑结构和病变的自动标记、可视化、体积量化以及标准化摄取值比(SUVR)分析。定量结果可与标准参考数据对比,辅助评估神经退行性变和认知障碍。
获得FDA批准的美国版Neurophet AQUA AD Plus是基于原有功能的升级版本。通过AI驱动的脑部MRI分析,该软件能够自动分析并量化与脑微出血、浅表铁质沉着症相关的低信号病灶,以及与脑水肿相关的高信号病灶。
该软件提供自动病灶定位和计数功能,帮助临床医生更精确地评估影像风险因素。在评估接受阿尔茨海默病治疗管理的患者时,支持做出基于个体情况的临床决策。
“Neurophet AQUA AD Plus获得FDA 510(k)许可是一个重要里程碑,使我们能够更广泛地将先进的阿尔茨海默病成像技术引入美国市场,”Neurophet联合首席执行官Jake Junkil Been表示,“我们计划通过加强与医疗机构和战略伙伴的合作,加速在美国的扩张。”
Neurophet AQUA AD Plus已于2025年9月在韩国被指定为创新医疗技术。基于这一进展,该公司计划在全球医疗环境中逐步扩大该解决方案的临床应用,进一步拓展其在AI神经影像领域的全球影响力。