和黄医药上海基地零缺陷通过FDA检查
2026-01-29 09:53
收藏
2026年1月,和黄医药中国上海旗舰生产基地迎来美国FDA现场检查,并以“零483缺陷项”的优异成绩顺利通过。此前,2023年其中国苏州工厂以零缺陷通过FDA批准前检查,推动呋喹替尼在美国上市,2025年又通过监督检查。此次中国上海基地通关,创下和黄医药连续三次美国FDA现场检查全部“零483缺陷项”通过的纪录,至此,中国上海、苏州两大生产基地均获呋喹替尼海外供药资质,与瑞士库威生产基地共同保障FRUZAQLA®全球供药。

中国上海旗舰生产基地是和黄医药核心制造平台,占地43亩,总建筑面积约55000平方米,2023年底竣工投产,先供应临床用药,2024年10月起供应商业用药。此次“零483缺陷项”通过及FDA认证,保障了公司全球供应链稳定性和产品质量,实现“张江研发、上海制造、中国原创、走向全球”的创新全链条。
本次FDA检查对注册申报资料、生产流程、六大系统、质量管理体系及整体合规水平全面严格审核。中国上海生产基地经近一年系统准备,凭借专业性与敬业精神获检查官认可。和黄医药坚持“零容忍”合规底线,构建的国际化管理体系成为通关关键,质量团队展现了精益求精的精神,践行了完善质量管理体系的目标,也体现了公司核心价值观。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

2026分子胶药物研发国际研讨会在中国上海成功举办
2026-01-29

Pinnacle Food全资子公司与Bioboost签署生物技术研究合作协议
2026-01-29
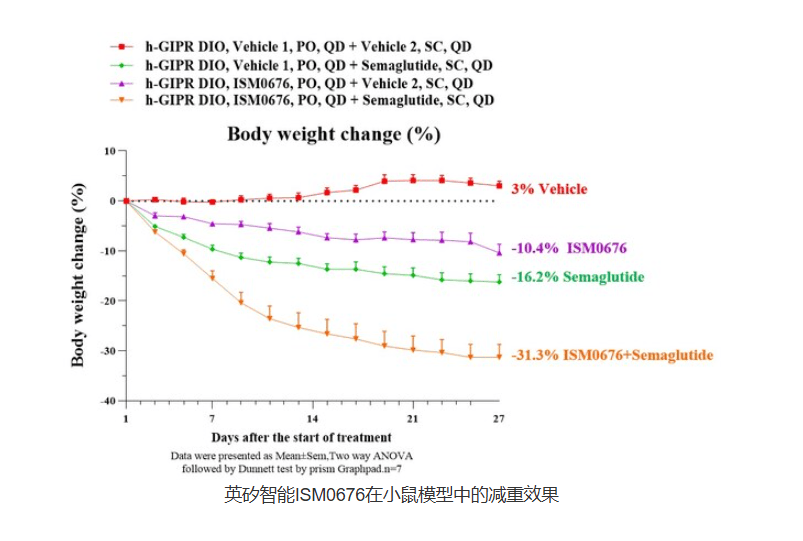
英矽智能AI赋能GIPR拮抗剂ISM0676成临床前候选化合物
2026-01-29

药明生物与生诺医药达成合作,加速创新双抗开发和生产
2026-01-29

盟科药业抗菌新药MRX-5片获美国FDA临床试验许可
2026-01-29

长春高新子公司伏欣奇拜单抗注射液临床试验申请获受理
2026-01-29

鱼跃医疗子公司持续葡萄糖监测系统获欧盟MDR认证
2026-01-29

三鑫医疗一次性无菌透析护理包获欧盟MDR认证
2026-01-29
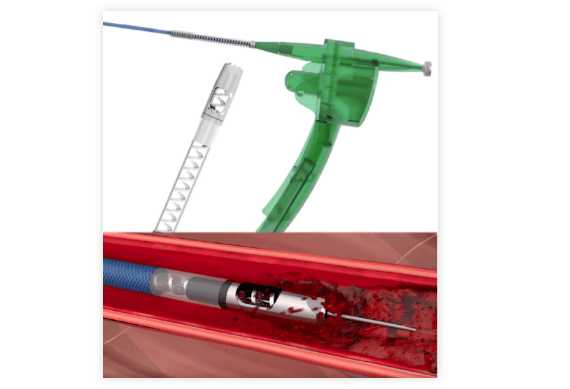
中国江苏金泰外周血管血栓旋切导管获批
2026-01-29

诺纳生物参与发起免疫疾病转化医学创新联盟
2026-01-29

