FDA对阿斯利康Saphnelo皮下给药申请发布完整回复函,系统性红斑狼疮治疗进展
2026-02-04 11:57
收藏
美国食品药品监督管理局已针对英国阿斯利康研发的Saphnelo生物制剂用于成人系统性红斑狼疮患者皮下给药的许可申请,发布了一份完整回复函。Saphnelo生物制剂药物通用名为anifrolumab,此次申请涉及给药方式的变更。

作为Saphnelo生物制剂药物的开发企业,英国阿斯利康公司已根据监管机构的要求补充了相关信息,并表示将继续与FDA保持沟通,以推动申请流程。监管机构对于Saphnelo生物制剂更新申请的最终决定,预计将于2026年上半年公布。目前,Saphnelo生物制剂药物的静脉注射剂型仍在市场上正常销售。
英国阿斯利康此前向FDA提交的申请主要依据一项名为TULIP-SC的III期临床试验的中期分析数据,该研究评估了Saphnelo生物制剂皮下给药的效果,并达到了预设的主要研究目标。Saphnelo生物制剂试验中观察到的安全性数据与已知的静脉输注给药临床特征基本吻合。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐
AdvanCell与48Hour Discovery合作开发212Pb靶向放射疗法
2026-02-04
RevealDX人工智能肺结节诊断软件获FDA批准
2026-02-04
Quest Diagnostics推出骨髓瘤流式细胞术MRD血液检测
2026-02-04

FDA对阿斯利康Saphnelo皮下给药申请发布完整回复函,系统性红斑狼疮治疗进展
2026-02-04

Bioxytran与明尼苏达大学合作推进碳水化合物科学平台研究
2026-02-04

默沙东后Keytruda时代战略布局,未来十年年收入机遇超700亿美元
2026-02-04

Health Catalyst通过近实时数据与AI驱动医疗临床改进行动
2026-02-04

Cycle收购Applied Therapeutics生物制药公司,开展罕见代谢疾病治疗领域
2026-02-04
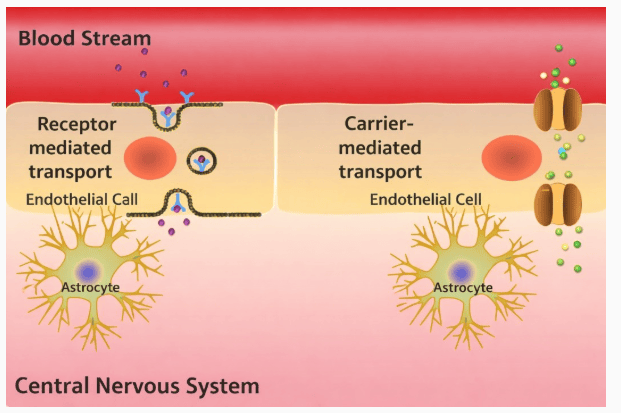
鼻脑给药技术优势显著,MetP Pharma展示临床前研究数据
2026-02-04
美敦力Hugo手术机器人获FDA批准为外科医生提供新选择
2026-02-04

