中国国家药监局表示2026年3月起化学药品等全面推行eCTD电子申报
2026-01-16 08:58
收藏
1月15日消息,中国国家药监局近日宣布,自2026年3月1日起,中国化学药品、化学原料药及生物制品的药物临床试验申请、药品上市许可注册申请、补充申请、境外生产药品再注册申请以及仿制药一致性评价申请等,将全面采用药品电子通用技术文档(eCTD)方式申报。旨在提升药品审评审批效率,推动药品注册管理数字化升级。

根据政策安排,修订后的eCTD相关技术文件将由中国国家药监局药品审评中心另行发布,原技术规范自2026年3月1日起废止。为鼓励企业提前适应电子申报模式,中国国家药监局明确,自2026年3月1日起1年内,采用eCTD方式申报的药品上市许可申请将纳入受理靠前服务范围。受理审查环节将对这类申请单独排队,确保3日内完成审查,进一步缩短审批周期。
业内人士指出,eCTD电子申报是国际通行的药品注册标准,其推广有助于统一申报资料格式,提高数据可追溯性和审评透明度。对于企业而言,电子申报可减少纸质资料准备与邮寄成本,同时便于跨地区、跨部门协作。随着政策落地,中国药品注册管理将与国际规则更紧密衔接,为创新药研发与上市提供更高效的环境。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

中源协和子公司获中国首款飞行时间质谱法肿瘤伴随诊断试剂盒注册证
2026-03-02

心脉医疗Hector®胸主动脉支架获美国FDA突破性认定
2026-03-02

默沙东贝组替凡两项III期研究数据公布
2026-03-02
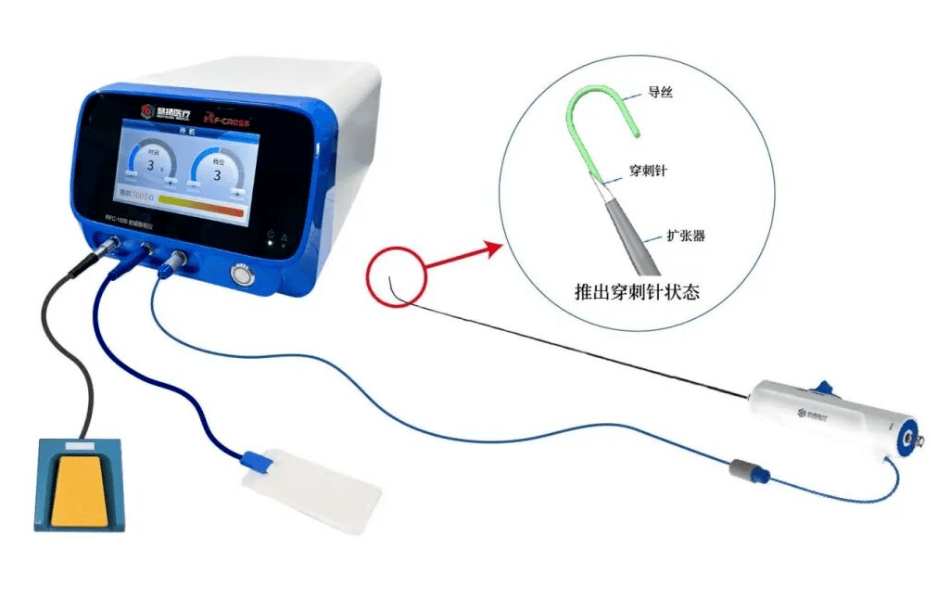
慧扬医疗RF-cross®射频房间隔穿刺系统获批,推动中国心脏介入手术升级
2026-03-02
AI基础模型BrainIAC在脑部MRI诊断中的潜力分析
2026-03-02

强生医疗科技公布Omnypulse与Varipulse脉冲场消融平台临床数据
2026-02-09

虚拟糖尿病预防项目获医保覆盖,数字健康服务惠及百万患者
2026-02-09
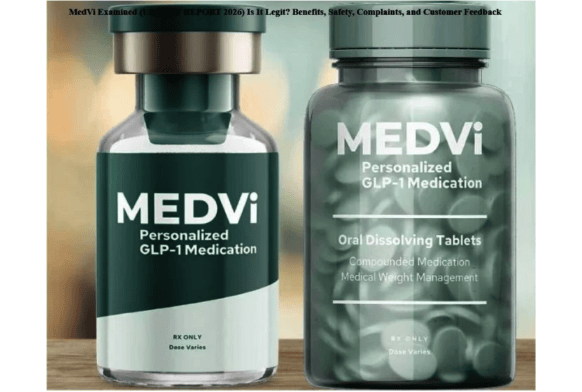
MEDVi远程医疗平台提供GLP-1减重治疗服务
2026-02-09

茶的健康益处,抗氧化剂如何帮助对抗慢性疾病
2026-02-09
内窥镜手术技术创新与临床应用进展
2026-02-09

