BNT113获FDA快速通道认证,加速癌症治疗研发
2026-01-22 12:12
收藏
德国生物科技公司BioNTech宣布,其试验性mRNA癌症免疫疗法BNT113获美国食品药品监督管理局(FDA)授予快速通道认证,用于治疗表达PD-L1的人类瘤病毒16型(HPV16+)头颈鳞状细胞癌(HNSCC)患者。这一认证旨在加速针对严重疾病且存在未满足医疗需求的癌症治疗药物开发进程,为BNT113的临床推进提供政策支持。

BNT113的快速通道认定基于正在进行的AHEAD-MERIT关键第二/三期临床试验数据。该试验评估BNT113与默克公司PD-1抑制剂Keytruda联用,作为不可切除、复发或转移性HPV16+ HNSCC且表达PD-L1患者的一线癌症治疗方案。初步结果显示,联合疗法在安全性与初步疗效上具备可行性,为后续癌症治疗研究奠定基础。
头颈鳞状细胞癌与高风险HPV感染密切相关,其中HPV16型占比最高。现有癌症治疗手段对晚期患者疗效有限,而免疫联合疗法有望通过激活患者自身免疫系统提升生存率。BioNTech表示,BNT113通过mRNA技术编码HPV16抗原,可诱导特异性T细胞反应,与Keytruda的协同作用或为该类癌症患者提供新选择。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

三星电子与b.well Connected Health合作推进数字健康转型以优化患者就医流程
2026-03-11

比利时Naobios与SGS合作生产RSV病毒攻击剂,加速疫苗研发评估
2026-03-11
强生向EMA提交TECVAYLI®单药疗法申请,治疗多发性骨髓瘤
2026-03-11
英国格拉斯哥EnteroBiotix完成异基因干细胞移植前EBX-102-02的2a期试验入组
2026-03-11
Kainova Therapeutics宣布口服EP4受体拮抗剂DT-9081在晚期实体瘤I期研究中取得积极成果
2026-03-11

西班牙CNIC团队研究证明远程缺血预适应可保护化疗患者心脏功能
2026-03-11

InstantScripts在澳大利亚实现1000万次远程医疗服务交付
2026-03-11

Telix旗下TLX591-Tx在III期研究中达成主要目标,用于癌症治疗
2026-03-11

加拿大缺铁性贫血诊疗指南更新,多学科合作应对公共卫生挑战
2026-03-11
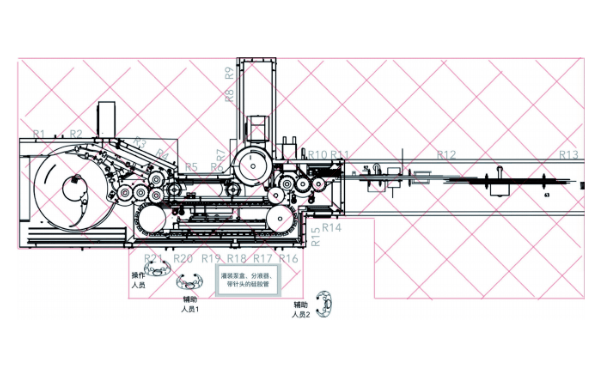
中国无菌制剂生产优化无菌保障措施以提升药品安全
2026-03-11
