糖尿病足治疗新药物获FDA快速通道资格
2026-01-25 10:14
收藏
近日,生物技术公司INTENT Biologics宣布,其自主研发的外泌体药物PEP Biologic™获美国食品药品监督管理局(FDA)“快速通道”资格,用于糖尿病足治疗,相关新药临床试验申请编号为IND 019567。FDA还同意其初步儿科研究计划,支持在生物制品许可申请(BLA)中申请全面儿科研究豁免。该机制旨在加速针对严重疾病且存在显著未满足临床需求药物的研发与审评,获得资格后,公司可与FDA更频繁沟通,分阶段提交BLA资料,未来有望加速审批。

糖尿病足是糖尿病患者常见严重并发症,全球约19%至34%的糖尿病患者会遭遇此类问题,不仅增加截肢风险,还推高医疗支出。目前临床糖尿病足治疗手段难以实现持久愈合,患者死亡率居高不下。PEP Biologic™是一种源自血小板的外泌体生物药,通过递送再生信号分子,调节免疫反应、促进组织修复,缓解炎症并推动组织再生。该产品基于INTENT Biologics独有的外泌体技术平台开发,由梅奥诊所Van Cleve心脏再生医学项目研发,依托RION血小板来源外泌体生产工艺,以冻干粉末形式稳定储存。
INTENT Biologics高管表示,若进展顺利,PEP Biologic™将成为近30年来首个获FDA批准用于糖尿病足治疗领域的生物制剂,也将是全球首款获批的外泌体疗法。目前,公司已完成II期临床试验,正推进关键性III期试验,并筹备注册申报和商业化工作。
本简讯来自全球互联网及战略合作伙伴信息的编译与转载,仅为读者提供交流,有侵权或其它问题请及时告之,本站将予以修改或删除,未经正式授权严禁转载本文。邮箱:news@wedoany.com
相关推荐

三星电子与b.well Connected Health合作推进数字健康转型以优化患者就医流程
2026-03-11

比利时Naobios与SGS合作生产RSV病毒攻击剂,加速疫苗研发评估
2026-03-11
强生向EMA提交TECVAYLI®单药疗法申请,治疗多发性骨髓瘤
2026-03-11
英国格拉斯哥EnteroBiotix完成异基因干细胞移植前EBX-102-02的2a期试验入组
2026-03-11
Kainova Therapeutics宣布口服EP4受体拮抗剂DT-9081在晚期实体瘤I期研究中取得积极成果
2026-03-11

西班牙CNIC团队研究证明远程缺血预适应可保护化疗患者心脏功能
2026-03-11

InstantScripts在澳大利亚实现1000万次远程医疗服务交付
2026-03-11

Telix旗下TLX591-Tx在III期研究中达成主要目标,用于癌症治疗
2026-03-11

加拿大缺铁性贫血诊疗指南更新,多学科合作应对公共卫生挑战
2026-03-11
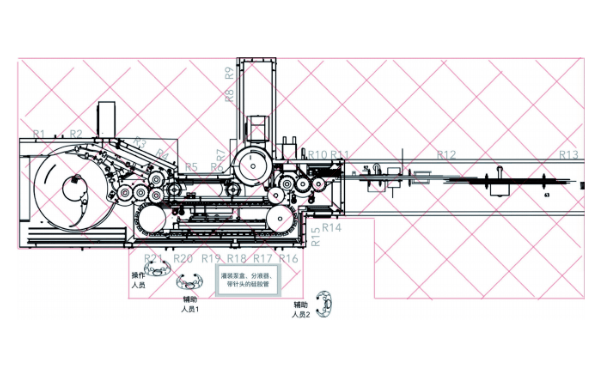
中国无菌制剂生产优化无菌保障措施以提升药品安全
2026-03-11
